GANGGUAN SPERMATOGENESIS SETELAH PEMBERIAN MONOSODIUM GLUTAMAT PADA MENCIT (MUS MUSCULUS L.)
on
JURNAL BIOLOGI XV (2) : 49 - 52
ISSN : 1410 5292
GANGGUAN SPERMATOGENESIS SETELAH PEMBERIAN MONOSODIUM GLUTAMAT PADA MENCIT (Mus musculus L.)
THE DISTURBANCE ON SPERMATOGENESIS AFTER ADMINISTRATION OF MONOSODIUM GLUTAMATE ON MICE (Mus musculus L.)
A.A.Sg.A Sukmaningsih, I Gusti Ayu Manik Ermayanti, Ngurah Intan Wiratmini, Ni Wayan Sudatri Jurusan Biologi, FMIPA, Universitas Udayana, Kampus Bukit Jimbaran Email: asukmaningsih@yahoo.com
INTISARI
Penelitian mengenai pemberian monosodium glutamat (MSG) pada 32 ekor mencit jantan berusia 12 minggu telah dilakukan untuk mengetahui pengaruh MSG terhadap spermatogenesis pada mencit (Mus musculus L). Mencit dibagi menjadi 4, kelompok sesuai dosis MSG yang digunakan yakni kontrol, 1,5 mg/bb, 3,0 mb/bb dan 4,5 mg/bb. Perlakuan MSG dalam aquades diberikan secara oral setiap hari sekali selama 35 hari, Setelah perlakuan dilakukan pembedahan hewan untuk pembuatan sediaan mikroanatomi testis. Pengamatan dilakukan pada tubulus Seminiferus testis tingkat VII dan VIII yang meliputi jumlah spermatogonia, spermatosit pakiten dan spermatid 15. Hasil penelitian menunjukkan terjadi gangguan spermatogenesis setelah pemberian Monosodium glutamat (MSG). Hal ini dapat terlihat dari hasil analisis data dengan Uji one way Anova dimana terjadi penurunan jumlah spermatosit pakiten secara bermakna (p < 0,05). Terjadi pula penurunan jumlah spermatid 15 secara bermakna setelah dianalisis dengan uji Kruskall Wallis dimana (p < 0,05).Diduga mekanisme gangguan spermatogenesis bersifat testikuler melalui terbentuknya radikal bebas dan stress oksidatif pada testis.
Kata kunci : MSG, Mus musculus L., Spermatogenesis
ABSTRACT
This study was conducted to investigate the effect of monosodium glutamate (MSG) on spermatogenesis of male experimental mice.using 32 twelve-week old mice. They were divided randomly into 4 groups, each group consisted of 8 mice. One group was used as control, three groups were used as treatment, which received 1.5 mg/g body weight/ day, 3 mg/g body weight/day and 4.5 mg/g body weight/day of MSG solution in destilled water for 35 days. The result showed that MSG treatment led to disturbance on spermatogenesis by reduction in some of the parameter studied. There was asignificant (p < 0.05) decrease in the number of pachytene spermatocyte and spermatid 15 , Where as the decrease in spermatogonia was insignificant (p>0.05).
Keywords : MSG, Mus musculus L., Spermatogenesis
PENDAHULUAN
Monosodium glutamat (MSG) berupa bubuk kristal berwarna putih sejak lama telah digunakan sebagai bahan tambahan pada berbagai jenis makanan di berbagai negara. Kandungan garam natrium asam glutamat pada MSG berfungsi sebagai penguat dan penyedap rasa bila ditambahkan terutama pada makanan yang mengandung protein. Glutamat adalah salah satu jenis asam amino penyusun protein dan merupakan komponen alami dalam setiap makhluk hidup baik dalam bentuk terikat maupun bebas. Semua makanan yang mengandung protein seperti daging, ikan, susu dan tanaman banyak mengandung glutamat. Glutamat yang masih terikat dengan asam amino lain sebagai protein tidak memiliki rasa tetapi dalam bentuk bebas memiliki rasa gurih. Semakin tinggi kandungan glutamat bebas dalam suatu makanan, semakin kuat rasa gurihnya. Glutamat bebas dalam makanan sehari-hari umumnya rendah, sehingga untuk memperkuat cita rasa perlu adanya tambahan
bumbu-bumbu yang kaya kandungan glutamat bebas. Glutamat bebas tersebut bereaksi dengan ion natrium membentuk garam MSG.
Diketahui komposisi senyawa MSG adalah 78% glutamat, 12% natrium dan 10% air (Winarno, 2004). MSG bila larut dalam air ataupun saliva akan berdisosiasi menjadi garam bebas dan menjadi bentuk anion dari glutamat. Glutamat akan membuka channel Ca2+ pada neuron yang terdapat taste bud sehingga memungkinkan Ca2+ bergerak ke dalam sel dan menimbulkan depolarisasi reseptor dan potensial aksi yang sampai ke otak lalu diterjemahkan sebagai rasa lezat (Siregar, 2009). Pada tahun 1995 MSG telah digolongkan sebagai bahan tambahan makanan yang aman seperti garam, cuka dan baking powder tetapi penggunaannya dibatasi sebanyak 120 mg/kg berat badan/hari oleh FDA dan WHO (Ardyanto, 2004). Pada mulanya masyarakat Jepang, Korea, Cina dan Thailand hanya menggunakan MSG sebanyak 30 – 60 mg. Setelah harga MSG menjadi murah, penggunaan MSG menyebar ke seluruh dunia termasuk Indonesia, penggunaan MSG
menjadi tidak wajar dan berlebihan dengan takaran 100 – 300 mg. Hasil survei Yayasan Lembaga Konsumen Indonesia (YLKI) pada tahun 1990an menemukan bahwa para pedagang mie bakso, mie pangsit dan mie rebus di Jakarta menggunakan MSG sebanyak 1840 – 3400 mg/ mangkok (Setiawati, 2008).
Prawiroharjono (2000) telah melakukan penelitian di Indonesia mengenai penggunaan MSG pada makanan untuk sarapan pagi, siang dan malam sebanyak 1,5 -3,0 gram per hari menunjukkan tidak terdapat gejala MSG Complex syndrom (Ardyanto, 2004) seperti rasa panas di leher, lengan dan dada, sakit kepala, pusing, mual, muntah dan berebar debar. Tetapi penggunaan secara berlebihan dapat menimbulkan gangguan lambung, gangguan tidur dan mual-mual. Bahkan beberapa orang ada yang mengalami reaksi alergi berupa gatal, dan panas. MSG juga dapat memicu hipertensi, asma, kanker diabetes, kelumpuhan serta penurunan kecerdasan. MSG sebanyak 4 mg/g bb pada tikus menyebabkan terjadinya peningkatan kadar MDA (malondialdehid) pada hati, ginjal, dan otak (Farombi dan Onyema, 2006).
Penelitian Vinodini et al. (2008) mengenai pemberian MSG 4 gram/ kg berat badan pada tikus jantan menunjukkan penurunan berat testis, jumlah spermatozoa dan peningkatan jumlah spermatozoa rusak di epididimis dibandingkan dengan kontrol. Pemberian MSG 4 mg/g berat badan terhadap sistem reproduksi secara intraperitoneal pada tikus yang baru lahir sampai berusia 10 hari dan diperiksa pada usia prapubertas menunjukkan terjadinya hiperleptinemia, hiperadiposit, peningkatan kadar kortikosteron, penurunan berat testis, serta penurunan kadar FSH, LH, dan tiroid (Nayanatara dan Vinodini, 2008)
Spermatogenesis adalah suatu proses perkembangan sel-sel spermatogenik yang membelah beberapa kali dan akhirnya berdiferensiasi menghasilkan spermatozoa. Sel-sel spermatogenik terdiri atas spermatogonium, spermatosit primer, spermatosit sekunder, dan spermatid yang tersebar dalam empat sampai delapan lapisan yang menempati ruangan antara lamina basalis dan lumen tubulus. Spermatogenesis dibedakan menjadi tiga tahap yaitu tahap spermatositogenesis atau tahap proliferasi, tahap meiosis dan tahap spermiogenesis.
Waktu yang dibutuhkan untuk menyelesaikan setiap langkah perkembangan sel spermatogenik berbeda, oleh karena itu akan terjadi berbagai bentuk kombinasi sel dari berbagai jenis perkembangan sel – sel germinal di dalam tubulus seminiferus. Kombinasi ini terjadi pada setiap bagian tubulus seminiferus disebut sebagai asosiasi sel dan membentuk stadium epithel seminiferus. Oakberg dan Rugh telah membagi epitel germinal tubulus seminiferus menjadi 12 tingkat yaitu tingkat I – XII (Hess et al., 2008). Spermatogenesis pada mencit memerlukan waktu selama 35,5 hari setelah menempuh 4 kali daur epitel seminiferus. Lama satu daur epitel seminiferus pada mencit adalah 207 ± 6 jam (Johnson and Everitt, 1990). Susunan sel-sel spermatogenik pada epitel tubulus seminiferus pada mencit telah diklasifikasikan oleh Oakberg (Hess et al., 2008)). Spermatogonia terdapat pada seluruh tingkat epitel tubulus seminiferus. Spermatosit primer muncul pada
tingkat VI dan VII. Pada tingkat VII sampai tingkat XII ditemukan dua lapisan spermatosit primer dalam tubulus seminiferus. Lapisan spermatosit yang lebih muda terletak lebih dekat dengan membran basal. Lapisan ini merupakan spermatosit dalam fase istirahat yang ditemukan pada tingkat VII dan awal tingkat VIII. Spermatosit sekunder dalam waktu yang singkat hanya terdapat pada tingkat XII dan mulai memasuki tahap spermatid. Spermatogenesis memerlukan waktu lebih dari satu daur siklus epitel seminiferus. Tingkat 1- 8 dari spermiogenesis tumpang tindih dengan tingkat 13 - 16. Pada tingkat I tubulus seminiferus terdapat spermatid tingkat 13. Tingkat II dan III tubulus seminiferus mengandung spermatozoa tingkat 14. Sedangkan spermatozoa tingkat 15 ditemukan dalam tingkat IV - Vl. Spermatozoa tingkat 16 ditemukan pada tingkat VII dan VIII tubulus seminiferus. Pada tingkat VIII spermatozoa matang dikeluarkan ke lumen.
Berdasarkan hal tersebut, maka dilakukan penelitian yang bertujuan untuk mengetahui pengaruh pemberian MSG terhadap proses spermatogenesis pada mencit (Mus musculus L.).
MATERI DAN METODE
Tiga puluh dua ekor mencit jantan usia 12 minggu degan berat badan 25 – 30 g dikelompokkan secara acak menjadi 4 kelompok perlakuan MSG yang dilarutkan dalam aquades dengan dosis 0 mg MSG/g bb (K0, sebagai kontrol. hanya diberikan akuades) ; 1,5 mg MSG /g bb (P1 ) ; 3 mg MSG/g bb (P2) ; 4.5 mg MSG/g bb (P3). Perlakuan diberikan secara oral (gavage) sebanyak 0,2 ml/ekor dengan menggunakan spuit injeksi berkanul volume 1 ml setiap hari sekali selama 35 hari. Selama pemeliharaan makanan berupa pellet dan minuman disediakan secara ad libitum. Pada hari ke 36, dilakukan pembedahan dengan membunuh mencit secara dislokasi leher. Testis diambil untuk pengamatan spermatogenesis. Sediaan mikroanatomi testis dibuat dengan menggunakan metode paraffin. Larutan fiksatif yang digunakaadalah buffer formalin. Pewarnaan dengan menggunakan Haematoxylin Ehrlich-Eosin.
Pengamatan dilakukan dengan menghitung jumlah spermatogonia, spermatosit pakiten dan spermatid 15 pada tubulus seminiferus tingkat VII dan VIII. Hasil pengamatan spermatogenesis dianalisis dengan uji one way Anova untuk data berdistribusi normal dan memiliki varians yang homogen. Bila terdapat perbedaan yang bermakna dilanjutkan dengan uji LSD. Data dengan varians yang tidak homogen dianalisis dengan uji Kruskall Wallis. Bila terdapat perbedaan bermakna dilanjutkan dengan uji Mann-Whitney U.
HASIL
Berdasarkan hasil analisis data didapatkan bahwa terjadi penurunan jumlah spermatosit pakiten dan spermatid 15 secara bermakna dan penurunan jumlah spermatogonia secara tidak bermakna pada tubulus seminiferus yang diberi perlakuan MSG secara oral dibandingkan dengan kontrol.
Gangguan Spermatogenesis Setelah Pemberian Monosodium Glutamat pada Mencit (Mus musculus L.) [A.A.Sg.A Sukmaningsih, dkk.]
Pada Tabel 1. dapat dilihat bahwa nilai mean jumlah spermatogonia menunjukkan perbedaan yang tidak bermakna (P > 0,05) dengan F hitung 3,.270 dimana K0 = 38,54, P1 = 37,21, P2 = 34,25 dan P3 = 31,33. Nilai mean jumlah spermatosit pakiten menunjukkan perbedaan bermakna (p < 0.,05) dengan F hit. = 8,081 dimana K0 = 40,37, P1 = 31,46, P2 = 30,454 dan P3 = 30,54. Setelah dilanjutkan dengan uji LSD dengan Post Hoc Test didapatkan bahwa di antara kelompok perlakuan MSG terjadi perbedaan tidak bermakna terhadap jumlah spermatosit pakiten.
Tabel 1. Hasil analisis perbedaan rerata mean Spermatogonia dan sper-matosit pakiten dengan uji one way Anova
Variabel
Perlakuan
Ko P1 P2 P3
Spermatogonia 38,54a ± 5,20 37,21a ± 4,34 37,25a ± 4,78 31,33a± 5,50
Spermatosit pakiten 40,37a ± 3,72 31,46b ±4,52 30,54b ±4,61 30,54b±5,93
Huruf sama pada kolom sama menunjukkan perbedaan tidak bermakna. K0 (kontrol) ; P1 (1,5 mg MSG /g bb) ; P2 (3 mg MSG/g bb) ; P3 (4.5 mg MSG/g bb)
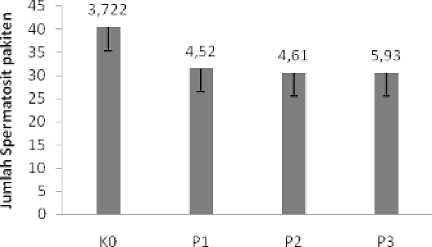
Perlakuan MSG
Gambar 1. Diagram batang jumlah spermatosit pakiten pada testis mencit (Mus musculus L.) kelompok kontrol dan perlakuan setelah pemberian MSG selama 35 hari. K0 (kontrol) ; P1 (1,5 mg MSG /g bb) ; P2 (3 mg MSG/g bb) ; P3 (4.5 mg MSG/g bb)
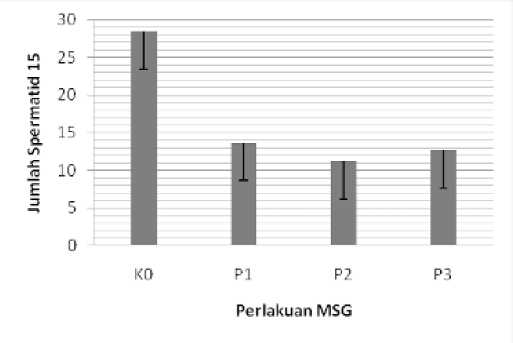
Pada Tabel 2. ranking nilai mean jumlah spermatid menunjukkan perbedaan bermakna (p < 0,05) dengan nilai Chi square = 17,78 dimana K0 = 28,50, P1 = 13,.63, P2 = 11,25 dan P3 = 12,63. Setelah dilanjutkan dengan Uji Mann Whitney U ( tabel 3) terdapat perbedaan tidak bermakna di antara semua kelompok perlakuan MSG yaitu antara P1 dan P2, P1 dan P3 serta P2 dan P3 menunjukkan nilai ( p > 0,05).
Tabel 2. Analisis Perbedaan Rerata Spermatid dengan Uji Kruskall Wallis
|
Variabel |
Perlakuan |
Rangking Mean |
Chi Square |
P |
|
Spermatid |
K0 |
28,50 | ||
|
P1 |
13,63 | |||
|
P2 |
11,25 |
17,78 |
0,002 | |
|
P3 |
12,63 |
Tabel 3. Hasil Analisis Perbedaan Spermatid di Antara Kelompok Perlakuan dengan Uji Mann Whitney
|
Variabel |
Perlakuan |
Nilai Z |
Nilai p |
|
Spermatid |
K0 vs p1 |
-3,411 |
0,001 |
|
K0 vs p2 |
-3,411 |
0,001 | |
|
K0 vs P3 |
-3,411 |
0,001 | |
|
P1 vs P2 |
-4,2 |
0,674 | |
|
P1 vs P3 |
-5,2 |
0,600 | |
|
P2 vs P3 |
-6,3 |
0,529 |
Gambar 2. Diagram batang jumlah spermatid pada testis mencit
(Mus musculus L.) kelompok kontrol dan perlakuan setelah pemberian MSG selama 35 hari. K0 (kontrol) ; P1 (1,5 mg MSG /g bb) ; P2 (3 mg MSG/g bb) ; P3 (4.5 mg MSG/g bb)
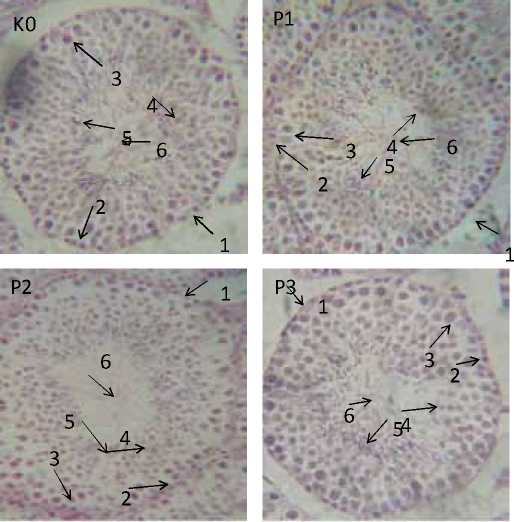
Gambar 3. Sayatan melintang tubulus seminiferus testis tingkat
VII- VIII pada mencit setelah pemberian MSG. K0 = kelompok kontrol. P1 = kelompok perlakuan 1,5 mg/bb. P2 = kelompok perlakuan 3,0 mg/bb. P3. Kelompok perlakuan 4,5 mg/bb. 1. Membran basalis. 2 spermatogonia. 3.Spermatosit pakiten. 4. Spermatid bundar. 5. Spermatid 15. 6 lumen dan spermatozoa.
PEMBAHASAN
MSG menyebabkan terjadinya gangguan spermatogenesis dimana terjadi penurunan jumlah spermatosit pakiten dan spermatid. Gangguan spermatogenesis dapat terjadi melalui 3 mekanisme bersifat antifertilitas yaitu ; pretestikuler, testikuler dan post testikuler. Mekanisme pretestikuler menghambat spermatogenesis melalui poros hipotalamus , hipofisis dan testis. LH yang menurun dalam serum akan mereduksi testosteron intratestikuler yang diikuti oleh penurunan
FSH sehingga produksi sperma terhambat. Penelitian mengenai pemberian MSG sebanyak 4 mg/g bb pada tikus menyebabkan penurunan kadar hormon testosteron plasma tetapi tidak menimbulkan perubahan morfologi tubulus seminiferus (Igwebuike et al., 2011). Tetapi penelitian yang dilakukan oleh Das dan Ghosh (2010) pemberian MSG sebanyak 2 mg/bb pada tikus baru lahir menunjukkan adanya peningkatan jumlah spermatosit pakiten secara bermakna, sel Leydig lebih besar, dan diameter tubulus seminiferus mengecil dibandingkan kontrol. Pemberian MSG sebanyak 4 mg/bb pada mencit menyebabkan penurunan jumlah sel Leydig tetapi tidak menyebabkan penurunan jumlah spermatozoa (Siregar, 2009)
Gangguan spermatogenesis melalui mekanisme testikuler bersifat sitotoksik. MSG menyebabkan terbentuknya radikal bebas yang berlebih dan menimbukan stress oksidatif. Penelitian mengenai pemberian MSG 4 mg./g bb selama 6 hari pada tikus usia 10 minggu menunjukkan adanya peningkatan radikal bebas secara bermakna pada kelenjar timus (Pavlovic, 2007). Penelitian oleh Nayanatara dan Vinodini (2008), pemberian MSG 4 g/ kg bb pada tikus putih secara intraperitoneal menyebabkan penurunan berat testis, peningkatan kadar peroksidase lipid yang ditandai dengan pembentukan senyawa aldehid terutama MDA dan kerusakan oksidatif serta penurunan asam askorbat testis. Defisiensi asam askorbat telah lama dihubungkan dengan jumlah spermatozoa yang rendah, peningkatan jumlah spermatozoa abnormal, dan penurunan motilitas spermatozoa (Suparni, 2009). Testis sebagai tempat berlangsungnya spermatogenesis bersifat sangat rentan terhadap proses oksidasi oleh radikal bebas Radikal bebas ini akan menimbulkan gangguan pada spermatogenesis dan membran spermatozoa. Membran sel spermatogenik mengandung sejumlah besar asam lemak tak jenuh rantai ganda. Bila radikal bebas yang terbentuk bertemu dengan asam lemak tak jenuh ganda dalam membran sel, akan terjadi reaksi peroksidasi lipid dari membran sel tersebut yang mengakibatkan peningkatan fluiditas membran, gangguan integritas membran dan inaktifasi ikatan membran dengan enzim dan reseptor. Hal ini akan menyebabkan peningkatan kerusakan sel termasuk spermatozoa (Suhadi, 1996), berkurangnya ATP intraseluler dengan cepat sehingga berakibat kerusakan aksonema, penurunan viabilitas spermatozoa, meningkatnya kerusakan morfologi midpiece serta kehilangan kemampuan kapasitasi dan reaksi akrosom spermatozoa (Sikka, 1996).
Berdasarkan hal tersebut, penurunan jumlah spermatosit pakiten dan spermatid 15 pada penelitian ini diduga MSG menyebabkan terbentuknya radikal bebas dan stress oksidatif serta peroksidasi lipid pada testis. Hal ini menimbulkan kerusakan sel sel spermatogenik pada tubulus Seminiferus. Sel spermatogenik yang rusak akan difagositasi oleh sel sertoli dan menyebabkan penurunan jumlah spermatid 15 dan spermatosit pakiten. Diketahui juga Spermatosit sangat sensitif terhadap pengaruh luar dan cenderung mengalami kerusakan pada tahap pakiten (Johnson and Everitt, 1990).
SIMPULAN
MSG dapat menyebabkan gangguan spermatogenesis dengan menurunkan jumlah spermatosit pakiten dan spermatid melalui mekanisme testikuler. Diduga terbentuk radikal bebas dan stress oksidatif pada testis yang mengakibatkan kerusakan sel spermatogenik.
KEPUSTAKAAN
Ardyanto, T.D. 2004. MSG dan Kesehatan : Sejarah, Efek dan Kontroversinya. Inovasi Vol 1/XVI/ Agustus.
Cahyadi W. 2008. Analisis dan Aspek Kesehatan. Bahan Tambahan Pangan. Edisi kedua. PT Bumi Aksara, Jakarta.
Das, R.S., S.K. Ghos. 2010. Long term effects of monosodium glutamate on spermatogenesis following neonatal exposure in albino mice – a histological study. Nepal Med. Coll. J. 12(3): 149-153
Farombi, E.O., O.O. Onyena. 2006. Monosodium Glutamate-Induced Oxidative Damage and Genotoxicity in The Rat: Modulatory Role of Vitamin C, Vitamin E and Quercetin. Hum. Exp. Toxicol. 25: 251-259
Hess R.A., L.R. de Franco. 2008. Spermatogenesis and Cycle of The Seminiferous Epithelium in Molecular Mechanism in Spermatogenesis. Edited by C.Y. Cheng. Landes Bioscience and Springer, London.
Igwebuike, U.M., I. S. Ochiogu, B. C. Ihedinihu, J.E. Ikokide., I.K. Idika. 2011. The Effect of Oral Administration o MSG on The testicular Morphology and Cauda Epididymal Sperm Reserves of Young and Adult Male Rats. Veterinarski Arhiv 81 (4) 525 – 534.
Johnson,M., B. Everitt.1988. Essential Reproduction. 3rd ed. Blackwell Sci. Pub. Oxford London Edinburg. p 50 – 200.
Nayanatara, AK., N.A Vinodini, G. Damodar, B. Ahemed, C.R. Ramaswamy, ShabarianthB.M. Ramesh. 2008. Role of ascorbic acid in monosodium glutamate mediated effect on testicular weight, sperm morphology and sperm count, in rat testis. J.
Chinese Clin. Med. 3: 1-5
Prawirohardjono, W., Dwiprahasto., I Astuti., Indwiani, S. Hadi-wandowo. 2000. The administration to Indonesians of monosodium L-glutamate in Indonesian foods: An assessment of Adverse Reactions in a Randomized Double-Blind, Crossover, Placebo Controlled Study. J. Nutrition 130, 1074S-1076S
Setiawati, F.S.N. 2008. Dampak Penggunaan MSG Terhadap Kesehatan Lingkungan. Orbith 4: 453 – 459
Sikka, C.S. 1996. Oxidative Stress and Role of Antioxidants in Normal and Abnormal Sperm Function. Department of Urology, Tulane University School of Medicine, New Orleans, Louisiana.USA.
Siregar, J.H. 2009. Pengaruh Pemberian Vitamin C Terhadap Jumlah Sel Leydig dan Jumlah Sperma Mencit Jantan Dewasa (Mus musculus L) Yang Terpapar Monosodium Glutamat (MSG) Tesis Pascasarjana. Universitas Sumatra Utara.
Suhadi, K. 1996. Spesies Oksigen Reaktif dan Kualitas Spermatozoa.
Medika. Vol.10. : 174 - 177
Suparni. 2009. Pengaruh Pemberian Vitamin C Terhadap Jumlah Sperma dan Morfologi Sperma Mencit Jantan Dewasa Yng dipaparkan Monosodium Glutamat (MSG). Tesis Pascasarjana. Universitas Sumatra Utara.
Vinodini, N.J., A.J Nayanatara,., G Damodara,., B.J Ahamed,., C Ramaswany,. 2008. Effect Of Monosodium Glutamate Induced Oxidative Damage on Rat Testis. J. Chinese Clin. Med. 3. 370 – 373.
52
Discussion and feedback