PENENTUAN KINETIKA ENZIM POLIGALAKTURONASE (PG) ENDOGENOUS DARI PULP BIJI KAKAO
on
JURNAL BIOLOGI XIII (1) : 21 -24
ISSN : 1410 5292
PENENTUAN KINETIKA ENZIM POLIGALAKTURONASE (PG) ENDOGENOUS DARI PULP BIJI KAKAO
DETERMINATION OF ENZYME KINETICS OF ENDOGENOUS POLYGALACTURONASE (PG) FROM COCOA PULP
G.P. GANDA PUTRA
Jurusan Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Universitas Udayana, Kampus Bukit Jimbaran, Bali
E-mail: putu_gandaputra@yahoo.com
INTISARI
Penelitian ini dilakukan untuk menentukan kinetika enzim poligalakturonase (PGs) endogenous (Km dan Vmaks) yang diisolasi dari pulp biji kakao. Penelitian dilaksanankan dengan menguji aktivitas isolat enzim PG endogenous pada variasi konsentrasi substrat citrus pectin antara 0,1 – 1,0% dengan interval 0,1%. Hasil yang diperoleh menunjukkan bahwa kinetika isolat enzim PG endogenous dari pulp biji kakao adalah Km sebesar 0,37% dan Vmaks sebesar 6,69 µmol asam galakturonat/menit/ml.
Kata kunci: kinetika enzim (Km, Vmaks), PGs, pulp kakao
ABSTRACT
This research was conducted to determine the enzyme kinetics (Km and Vmax) of endogenous polygalacturonase (PGs) isolated from cocoa pulp. This research was carried out by assaying PGs activities in various concentration of citrus pectin subtrates which were between 0,1 – 1,0% with 0,1% interval. The result showed that the enzyme kinetics of endogenous PGs from cocoa pulp (Km) was 0,37% and Vmax was 6,69 µmol of galacturonic acid/minute/ml.
Keywords: enzymatic kinetics (Km , Vmax), PGs, cocoa pulp
PENDAHULUAN
Penghancuran pulp dapat dilakukan dengan depolim-erisasi menggunakan enzim-enzim pektolitik endogenous. Depolimerisasi pektin dapat berlangsung karena adanya aktivitas enzim-enzim pektolitik yang menghidrolisis substrat pektin, yaitu polisakarida struktural pada dinding sel primer dan ruang antar sel. Aktivitas enzim tersebut dalam menghidrolisis pektin sehingga menyebabkan jaringan pulp rusak terdisintegrasi, membentuk cairan dan menetes keluar tumpukan biji (watery sweatings).
Pulp biji kakao mengandung pektin, sekitar 1-1,5% (Case, 2004), sehingga dimungkinkan adanya enzim-enzim pektolitik endogenous dalam pulp biji kakao. Ganda Putra, dkk. (2007), telah berhasil mengisolasi dan mengkarakterisasi secara parsial enzim-enzim pektolitik endogenous pada pulp biji kakao, diantaranya adalah enzim poligalakturonase (PG). Salah satu karakteristik enzim yang perlu dipelajari adalah kinetika enzim, berupa parameter Km dan Vmaks.
Dalam reaksi enzim dikenal kecepatan reaksi hidrolisis, penguraian atau reaksi katalisasi lain yang disebut velocity (V). Harga V dari suatu reaksi enzimatis akan meningkat dengan bertambahnya konsentrasi
Naskah ini diterima tanggal 16 April 2009 disetujui tanggal 23 Mei 2009
substrat [S], akan tetapi setelah [S] meningkat lebih lanjut akan sampai pada kecepatan yang tetap. Pada konsentrasi enzim tetap (tertentu) harga V hampir linier dengan [S]. Pada kondisi dimana V tidak dapat bertambah lagi dengan bertambahnya [S] disebut kecepatan maksimum (Vmaks). Vmaks merupakan salah satu parameter kinetika enzim (Wiesman, 1989).
Parameter kinetika enzim yang lain adalah konstanta Michaelis-Menten, yang lebih dikenal dengan Km. Km merupakan konsentrasi substrat yang separuh dari lokasi aktifnya telah terisi, yaitu bila kecepatan reaksi enzim telah mencapai ½ Vmaks (Wiesman, 1989).
Menurut Fox (1991), nilai Km dapat digunakan dalam menentukan ukuran afinitas enzim-substrat (E-S), yang merupakan suatu indikator kekuatan ikatan kompleks E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E dan S. Nilai Km kecil berarti kompleks E-S mantap, afinitas enzim tinggi terhadap substrat, sedangkan bila Km besar berlaku kebalikannya
Tujuan penelitian ini untuk menentukan parameter kinetika, Km dan Vmax, enzim poligalaturonase (PG) endogenous dari pulp biji kakao. Hasil penelitian nantinya diharapkan dapat digunakan sebagai acuan dalam menentukan standar prosedur dalam pemanfaatan
enzim PG untuk keperluan pengolahan kakao atau pengolahan pangan.
MATERI DAN METODE
Bahan penelitian adalah buah kakao jenis lindak yang langsung dipetik dari kebun kakao milik petani. Bahan lain adalah bahan-bahan kimia,diantaranya: alkohol 90%, Na-bisulfit, PEG 4000, bufer Na-asetat 0,05M, NaCl, citrus pektin dengan kadar asam galakturonat 93,5% dan metoksil 9,4% (SIGMA), asam D-galakturonat standar (SIGMA), pereaksi Nelson A, pereaksi Nelson B, pereaksi Arsenomolibdat.
Ekstraksi enzim
Ekstraksi enzim PME pada pulp biji kakao menggunakan prosedur ekstraksi enzim pektolitik pada buah-buahan (Munoz and Barcelo, 1996; Zhou et al., 2000).
Ekstrak pulp biji kakao ditimbang sebanyak 40 g, lalu ditambahkan 80 ml PEG 4000 12%; Na-bisulfit 0,2%. Campuran diaduk dengan pengaduk magnetik selama 10 menit dalam ruangan suhu 4oC (cool chamber). Setelah itu disentrifugasi pada 5.000 rpm, 4oC selama 20 menit. Supernatan dibuang, residunya dicuci dengan menambahkan Na-bisulfit 0,2% sebanyak 2 kali volume residu dan disentrifugasi lagi seperti di atas selama 10 menit.
Residu yang diperoleh ditampung dalam erlenmeyer 100 ml, kemudian ditambahkan 75 ml larutan bufer Na-asetat 0,05 M; NaCl 0,5 M (pH 5,0) untuk esktraksi enzim PG. Selanjutnya campuran tersebut diinkubasi sambil diaduk menggunakan pengaduk magnetik selama 1 jam pada suhu 4oC. Setelah itu disentrifugasi pada 5.000 rpm, 4oC selama 20 menit. Supernatan sebagai isolat enzim, ditampung dalam botol dan disimpan dalam lemari es (suhu -20oC) sebelum digunakan.
Penentuan kinetika enzim
Penentuan kinetika enzim PME (Vmaks dan Km) didasarkan atas plot grafik hubungan antara konsentrasi substrat [S] dan aktivitas enzim (V) (Fayyaz et al., 1995; Dinu, 2001).
Larutan substrat citrus pektin (SIGMA) dibuat dengan konsentrasi antara 0,1 – 1,0% dengan interval 0,1% dalam larutan buffer Na-asetat 0,05 M; NaCl 0,15 M (pH 4,5), lalu dilakukan pengujian aktivitas enzim sesuai prosedurnya. Setelah itu ditentukan aktivitas enzim (µmol asam galakturonat/menit/ml) pada masing-masing konsentrasi substrat.
Selanjutnya dibuat tabel V dan [S] dan dikonversi menjadi 1/V dan 1/[S] serta dibuat plot grafik hubungan antara 1/V dan 1/[S]. Lalu ditentukan nilai Vmaks danKm yang didasarkan atas persamaan kurva Lineweaver-Burk (Whitaker, 1996), dengan cara:
-
- Bahwa dari persamaan: 1/V = 1/Vmaks + Km/ Vmaks.(1/[S])
-
- Bila 1/V = Y dan 1/[S] = X, maka rumusnya dapat ditulis menjadi: Y = a + bX, sehingga: a = 1/Vmaks dan b = Km/Vmaks
-
- Dengan demikian, bila harga 1/Vmaks diketahui maka nilai Vmaks didapat, begitu pula nilai Km akan juga didapat dari persamaan b = Km/Vmaks.
Pengujian aktivitas enzim
Prosedur pengujian aktivitas enzim PG dengan metode kombinasi Munoz and Barcelo, (1996) dan Zhou et al. (2000): larutan substrat citrus pektin (SIGMA) 0,75 % disiapkan dalam bufer Na-asetat 0,05 M; NaCl 0,15 M (pH 4,5). Sebanyak 4 ml larutan substrat citrus pektin dan 1 ml isolat enzim PG dimasukkan dalam tabung reaksi. Campuran diinkubasi pada suhu 35oC dalam water bath selama 60 menit, setelah itu reaksi dihentikan dengan pemanasan pada suhu 100oC selama 5 menit. Sementara itu, blanko juga disiapkan dengan menginkubasi campuran sebanyak 1 ml filtrat enzim yang ditambahkan dengan 4 ml bufer Na-asetat 0,05 M; NaCl 0,15 M (pH 4,5). Setelah itu, diambil sebanyak 0,1 ml campuran dan ditambahkan 0,9 ml aquadest dengan mikro pipet, selanjutnya diperlakukan sesuai prosedur penentuan kadar asam galakturonat dengan metode Somogyi-Nelson. Nilai absorbansi selanjutnya dikonversi menjadi kadar asam galakturonat berdasarkan kurva standar asam D-galakturonat.
Unit aktivitas isolat enzim PG = 1 µmol asam galakturonat yang terbentuk per menit per ml isolat enzim PG atau µmol asam galakturonat/menit/ml.
HASIL
Aktivitas enzim PG endogenous pada beberapa konsentrasi substrat citrus pektin (Tabel 1), menunjukkan bahwa aktivitas enzim PG mula-mula meningkat secara signifikan sejalan dengan meningkatnya konsentrasi substrat, sampai pada konsentrasi substrat 0,9%, tetapi tidak signifikan setelah konsentrasi substrat ditingkatkan menjadi 1,0%.
Tabel 1. Aktivitas isolat enzim PG endogenous pada beberapa konsentrasi substrat pektin. Angka yang diikuti huruf yang sama tidak berbeda nyata menurut uji Beda Nyata Terkecil (BNT) pada taraf 5%.
|
Konsentrasi substrat (%) [S] |
Unit aktivitas (µmol asam galakturonat/ menit/ml) (V) |
1/[S] |
1/V |
|
0,1 |
1,49g |
10,00 |
0,67 |
|
0,2 |
2,07fg |
5,00 |
0,48 |
|
0,3 |
2,77ef |
3,33 |
0,36 |
|
0,4 |
3,23de |
2,50 |
0,31 |
|
0,5 |
3,85cd |
2,00 |
0,26 |
|
0,6 |
4,01c |
1,67 |
0,25 |
|
0,7 |
4,36bc |
1,43 |
0,23 |
|
0,8 |
4,89b |
1,25 |
0,20 |
|
0,9 |
5,61a |
1,11 |
0,18 |
|
1,0 |
5,64a |
1,00 |
0,18 |
|
BNT 5% |
0,8076 |
Penentuan Vmaks dan Km didasarkan atas persamaan garis regresi grafik hubungan antara 1/[S] dan 1/V (Tabel 1), seperti disajikan pada Gambar 1. Selanjutnya
dari persamaan regresi Y = 0,1494 + 0,0556 X, maka diperoleh: 0,1494 = 1/Vmaks sehingga Vmaks = 6,69 dan 0,0556 = Km/Vmaks sehingga Km = 0,37.
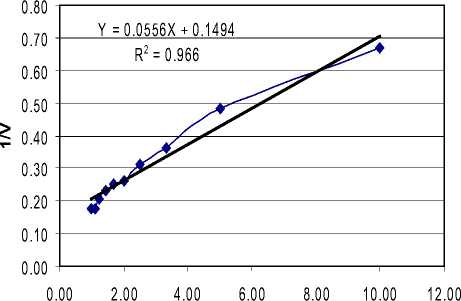
1/[S]
Gambar 1. Grafik hubungan antara 1/[S] dan 1/V
PEMBAHASAN
Aktivitas enzim PG yang mula-mula meningkat secara signifikan sejalan dengan meningkatnya konsentrasi substrat, tetapi tidak signifikan setelah konsentrasi substrat ditingkatkan lagi. Hal ini terjadi karena suatu reaksi enzimatis akan meningkat dengan bertambahnya konsentrasi substrat [S], akan tetapi setelah [S] meningkat lebih lanjut akan sampai pada kecepatan yang tetap. Pada kondisi dimana kecepatan reaksi enzimatis tidak dapat bertambah lagi dengan bertambahnya [S] disebut kecepatan maksimum (Vmaks) (Wiesman, 1989).
Penentuan Vmaks akan menghasilkan gambaran tentang sifat-sifat kinetika enzim lain, ½ Vmaks, yaitu suatu konsentrasi substrat yang separuh lokasi aktifnya telah terisi atau bila kecepatan reaksi enzimatis telah mencapai setengah dari kecepatan maksimum, yang dikenal dengan Km (tetapan Michaelis-Menten). Nilai Km digunakan selain sebagai ukuran afinitas E-S juga berhubungan dengan tetapan keseimbangan disosiasi kompleks E-S menjasi E dan S. Fox (1991), menambahkan bila nilai Km kecil berarti kompleks E-S mantap dan afinitas enzim terhadap substrat tinggi, sedangkan bila nilai Km besar afinitasnya menjadi rendah. Harga Km enzim sangat bervariasi tergantung dari jenis substrat, keadaan lingkungan dan kekuatan ion.
Hasil perhitungan penentuan Vmaks dan Km isolat enzim PG endogenous adalah sebesar 6,69 µmol asam galakturonat/menit/ml dan 0,37%. Hasil Vmaks enzim PG endogenous tersebut dapat dibandingkan dengan Vmaks enzim PG exogenous yang diisolasi dari bakteri tanah (Bacillus sp.), yaitu berkisar antara 9,07 - 11,51 µmol asam galakturonat/menit/mg protein (Wardhani, 2005) dan enzim ekso-PG I Penicillium frequentans sebesar 2571 µmol asam galakturonat/menit/mg protein (Barense
et al., 2001). Begitu pula dengan Vmaks enzim PG yang diisolasi dari Aspergillus niger sebesar 3133,3; 2974,4 dan 1892,9 µmol asam galakturonat/menit/mg protein , masing-masing untuk substrat natrium poligalakturonat, pektin termetilasi 6% dan pektin termetilasi 30% (Dinu, 2001).
Sementara itu, Km filtrat enzim PG endogenous dari pulp biji kakao sebesar 0,37% lebih besar dibandingkan dengan Km enzim PG exogenous yang diisolasi dari bakteri tanah (Bacillus sp.) berkisar antara 0,04 – 0,09 mg/ml (0,004 - 0,009%) (Wardhani, 2005), tetapi relatif sama dengan Km enzim ekso-PG I Penicillium frequentans sebesar 1,6 g/l (0,16%) (Barense et al., 2001). Data lain yang dilaporkan oleh Dinu (2001), menunjukkan bahwa Kmenzim PG yang diisolasi dari Aspergillus niger, berturut-turut sebesar: 0,94 mg/ml (0,094%) pada substrat natrium poligalakturonat, 1,1 mg/ml (0,11%) pada substrat pektin termetilasi 6% dan 1,98 mg/ml (0,198%) pada substrat pektin termetilasi 30%.
Perbedaan nilai Vmaks dan Km seperti di atas berhubungan dengan tingkat kemurnian enzim. Enzim yang murni memungkinkan sisi-sisi aktifnya dapat bereaksi secara lebih baik, sehingga meningkatkan aktivitasnya yang berdampak pada penurunan nilai Km. Selain itu enzim yang diekstraksi dari sumber berbeda akan memiliki sifat-sifat berbeda, terutama responnya terhadap kondisi lingkungan, seperti: suhu, pH dan konsentrasi NaCl optimum untuk aktivitasnya. Dinu (2001), menambahkan bahwa pada enzim PG, perbedaan nilai Vmaks dan Km juga dapat terjadi karena perbedaan derajat metilasi substrat pektin. Pektin dengan derajat metilasi lebih tinggi akan menghambat kecepatan reaksi enzimatis oleh enzim PG, sehingga akan meningkatkan nilai Km. Hal ini terlihat dari nilai Km enzim PG endogenous pulp biji kakao sebesar 0,37% pada subtrat citrus pektin termetilasi 9,4%, yang juga masih lebih tinggi dibandingkan dengan subtrat pektin termetilasi 30% (0,198%) karena masih berupa filtrat enzim kasar.
SIMPULAN
Dapat disimpulkan bahwa parameter kinetika isolate enzim poligalakturonase (PGs) endogenous dari pulp biji kakao adalah Vmaks sebesar 6,69 µmol asam galakturonat/ menit/ml dan Km sebesar 0,37%.
UCAPAN TERIMAKASIH
Artikel ini merupakan bagian dari hasil Penelitian Hibah Bersaing (Tahap I/2007), untuk itu penulis mengucapkan banyak terimakasih kepada DP2M Ditjen Dikti, Depdiknas RI yang telah membiayai penelitian ini.
KEPUSTAKAAN
Barense, R.I., M.A. Chellegatti, M.J.V. Fonseca and S. Said. 2001. Partial purification and characterization of exopolygalacturonase I and II of Penicillium frequentans. Braz. J. Microbiol., 32 (4): 5-8.
Case, C.L. 2004. The Microbiology of Chocolate. http://smccd. net/accounts/case/ chocolate.html. Diakses tanggal 18 Maret 2004.
Dinu, D. 2001. Enzymatic hydrolysis of pectic acid and pectins by polygalacturonase from Aspergillus niger. Roum. Biotechnol., 6 (5) : 397-402.
Fayyaz, A., B.A. Asbi, H.M. Ghazali, Y.B. Che-Man and S. Jinap. 1995. Kinetics of papaya pectinesterase. Food Chemistry, 53 : 129-135.
Ganda Putra, G.P., L.P. Wrasiati dan N.M. Wartini. 2007. Kajian Depolimerisasi Pulp Biji Kakao Oleh Enzim-Enzim Pektolitik Endojinus Sebagai Dasar Pengembangan Proses
Fermentasi Pada Pengolahan Kakao: (I) Isolasi, Karakterisasi dan Optimasi Enzim-Enzim Pektolitik Endojinus Pulp Biji Kakao. Laporan Penelitian Hibah Bersaing (Tahap I/2007). Fakultas Teknologi Pertanian, Universitas Udayana.
Munoz, R. and A.R. Barcelo. 1996. Enzymes. In L.M.L. Nollet (Ed.). Handbook of Food Analysis. Vol. 1. Marcel Dekker, Inc., New York.
Wardhani, O.R. 2005. Karakterisasi parsial poligalakturonase yang diisolasi dari bakteri tanah. Tesis S-2. Tidak Dipublikasikan. Program Pasca Sarjana Universitas Brawijaya, Malang.
Whitaker, J. R. 1996. Enzymes. In O. R. Fennema (Ed.). Food Chemistry. 3rd Edition. Maecel Dekker, Inc., New York.
Wiseman, A. 1989. Handbook of Enzymes Biotechnology. 2nd. Edition. Ellis Howard, New York.
Zhou, H.W., R. Ben-Arie and S. Lurie. 2000. Pectin esterase, polygalacturonase and gel formation in peach pectin fractions. Phytochemistry, 55 : 191-195.
24
Discussion and feedback