KEMAJUAN PENELITIAN BIOSINTESIS MONOTERPENA DAN PERANAN Terpene Cyclase: Suatu Kajian Pustaka
on
P ISSN: 1410-5292,
JURNAL BIOLOGI UDAYANA 22 (2): 85 –90 E ISSN: 2599-2856
KEMAJUAN PENELITIAN BIOSINTESIS MONOTERPENA DAN
PERANAN Terpene Cyclase: Suatu Kajian Pustaka
PROGRESS OF RESEARCH BIOSYNTHESIS MONOTERPENE AND THE ROLE Terpene Cyclase: A Review
Mario Nikolaus Dalengkade1, Ferry Fredy Karwur2*
-
1) Magister Biologi Universitas Kristen Satya Wacana
-
2) Fakultas Kedokteran dan Ilmu Kesehatan Universitas Kristen Satya Wacana Email: ferry.karwur@staff.uksw.edu
Diterima 27 April Disetujui 27 Desember 2018
INTISARI
Perpanjangan rantai, pemutusan ikatan‒π, dan penataan kembali ikatan C dari suatu reaksi kompleks oleh siklase menciptakan substrat universal untuk biosintesis C10. Dari substrat tersebut mengakibatkan melimpahnya C10 di alam. Sehingga disepakati oleh peneliti sebagai postulat. Kajian-kajian mekanika dan genetik juga membuktikan postulat tersebut. Selain itu keterlibatan ion-ion logam sebagai pengikat berperang penting dalam biosintesis C10 dan pengaturannya.
Kata kunci: C10‒synthase, gen, divalent/monovalent
ABSTRACT
Chain extension, bond‒π termination, and rearrangement of C bonds from complex reactions by cyclase create a universal substrate for C10 biosynthesis. From this substrate it consumes abundant C10 in nature. Approved by the researcher as a postulate. Mechanical and genetic studies also prove the postulate. In addition, metal ions as a binder play an important role in C10 biosynthesis and its regulation.
Keywords: C10‒synthase, gen, divalent/monovalent
PENDAHULUAN
Ditemukannya ke-12 jenis tumbuhan antara lain Myristica fragrans dan Cananga ordorata sebagai penghasil minyak atsiri, sehingga Indonesia dapat memproduksi minyak atsiri yang bernilai ekonomi di dunia (Departemen Perdagangan Republik Indonesia, 2011; Oyen dan Dung, 1999). Dalam tulisan Hofberger et al, (2015) minyak atsiri adalah golongan senyawa terpena dengan monomer berupa unit isoprena (C5) berjumalah 200.000, dan dipisahkan menjadi C10 sampai C40.
Jones et al, (2008) melaporkan kandungan dalam Santalum album L. antara lain α-pinene, sabinene, dan limononene merupakan golongan senyawa terpena yakni C10 sebagai pembangun minyak atsiri. Karena C10 bervarietas, sehingga Devon dan Scott, (1972) memetakan berdasarkan hasil rekayasa genetik menjadi 380 spesies dari 15 famili adalah sebagai berikut; rantai lurus C5 (reguler dan ireguler), C10 sikloheksana, C10 untuk 3-siklik, C10 alkaloid, C10 siklopentana, mentana, C10 siklopentana. Menilik kembali mengenai minyak atsiri, teka-teki yang menantang yakni, “bagaimana beragam tumbuhan penghasil minyak esensial menghasilkan begitu beragamnya senyawa monoterpena?” Dalam tulisan ini,
akan mengkaji kembali C10 pada lingkupan perubahan rantai C disebabkan oleh karakteristik siklase.
ALUR KONVENSIONAL BIOSINTESIS MONOTERPANA
Biosintesis C10 yang telah diuraikan oleh Mahmoud dan Croteau (2002); Dudareva et al, (2004) yakni: 1) penyusunan kedua C5/3-methylbut-3-enyl phosphono hydrogen phosphate (IPP dengan DMAP), 2) Penyatuan IPP dengan DMAP, guna membentuk geranil pirofosfat (GPP; C10); 3) Oleh enzim GPP dirubah ke bentuk utama sub-anggota C10; 4) Pengalihan bentuk utama ke sub-
keluarga C10 oleh enzim ke berbagai senyawa turunan.
BIOSINTESIS IPP DAN DMAP
Mahmoud dan Croteau (2002); Banerjee dan Sharkey (2014) mengemukakan IPP maupun DMAP sebagai isomernya ialah hasil lintasan 3,5-Dihydroxy-3-
methylvalerate (MVA), dan Methyl-D-erythritol
phosphate disodium salt (MEP). Sharkey et al, (2008);
Rohmer et al, (1996); Rodrȋguez-Concepción dan Boronat (2002) menyimpulakan bahwa, dalam MEP terdapat 7 strata reaksi enzimatik. Berpangkal di 1-deoxy-d-xylulose-5-phosphate sodium salt (IspC) mengkatalisis 2-oxidanylidenepropanoate dan triose phosphate (GAP) membentuk deoxyxylulose-5-phosphate (DXP). Selepas itu mengalami redoks akibat IspCase memunculkan MEP lalu dibentuk 4-(cytidine 5'-diphospho)-ME (C2P-ME) oleh MEP-transferase (YgbP), sesudah itu memanfaatkan adenosina trifosfat dengan bantuan 2-phosphotransferase (IspE) menampakan 2-phospho-4-(cytidine 5'-diphospho)-2-C-methyl-D-erythritol (IspF). Di dua rekasi akhir transfigurasi terlaksana, karena dibantu protein constitutif subtilisin 3 (GcpE) dan protein kloroplas biogenesis 6 (LytB) untuk mencetak IPP dan DMAP.
REKAYASA Geranil Difosfat (GPP)
Laporan Jo Davisson et al, (1985); Cane (1979); Poulter et al, (1981); Poulter dan Rilling (1978) yakni reaksi fusi antar atom 1’‒4 berlangsung dalam sistem alil (1), kemudian oleh prenyltransferase diubah menjadi GPP asiklik (2) yang merupakan substrat awal pembentukan beragam C10. Peneliti lain adalah Poulter dan Rilling (1978); Popjak dan Cornforth (1966); Holloway dan Popjak (1968); Bouvier et al, (2000); Burke dan Croteau (2002) menyempurkan laporan tersebut yakni selama reaksi katalis berlangsung, secara geometri mengalami perubahan menjadi cis (4) dan trans (5) (homodimer serta heterodimer) untuk C5.
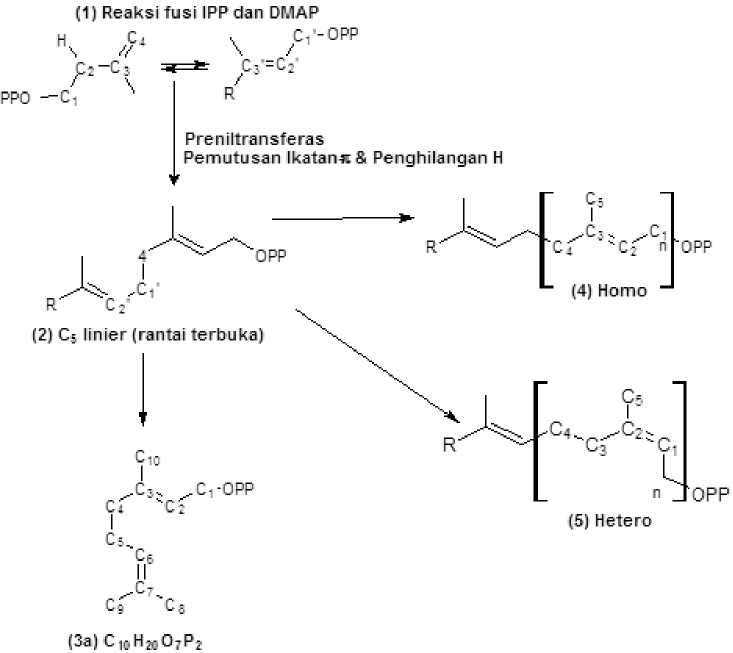
Gambar 1. Fusi antar atom C dan Geometri GPP (sumber modifikasi dari: Poulter, C.D., P.L. Wiggins., A.T. Le. 1981).
Poulter dan Rilling (1976) melaporkan bahwa terdapat energi penggerak sebesar 28 kcal/mol yang mampu memutar ikatan alilik C‒C, sehingga menyebabkan perubahan geometri GPP rantai terbuka (2) menjadi ikatan benzena GPP-asiklik (3a & b), dan memiliki kestabilan molekul (struktur ikatan valensi). Thulasiram et al, (2007) dalam percobaannya menemukan pengikatan antar atom yakni siklobutana dan siklopropana.
DARI GPP KE SUB-KELUARGA MONOTERPENA
Penyebab utama C10 sangat banyak karena siklase (berdasarkan sifatnya) mampu memproduksi senyawa turunan dan dikelompokan atas fungsi yakni asiklik atau bisiklik, dan monosiklik (Cane et al., 1991; Croteau et al., 2005; Noma dan Asakawa, 2010).
CARA GPP MEMBUAT BERAGAM MONOTERPENA
Faktor utama kenapa C10 begitu melimpah, karena terdapat dua molekul yang tidak stabil dengan waktu paruh pendek yakni LPP- transoid (linalil pirofosfat) (5) dan NPP-cisoid (neril pirofosfat) (6) adalah hasil reaksi ionisasi serta
isomerisasi dari prenyltransferase yang bermula di GPP. Peneliti terdahulu seperti Rojas et al, (1983); Croteau (1987) menyatakan pembentukan GPP, LPP, NPP merupakan postulat, semakin menguatkan ialah hasil percobaan Zhang dan Tiefenbacher (2015) membenarkan mengenai postulat tersebut.
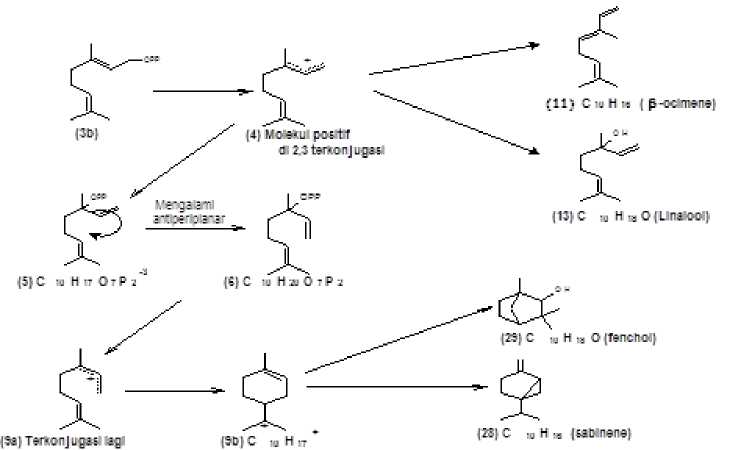
Gambar 2. Postulat dan varietas C10 (Sumber modifikasi dari : Croteau. R. 1987).
Pengembangan penelitian biosintesis C10 terus dilakukan sejak, Croteau (1986) sampai sekarang Hyatt et al, (2016) melaporkan bahwa keberhasilan pembuatan substrat analog dan proses kristalisasi 2‒fluorin‒GPP dan 2‒fluorin‒LPP sukses memunculkan fluorocineole, fluorobornanes, fluorinated olefins, serta fluorolimonene. Pihak lain yaitu Karp et al, (2007) menyampaikan pada kisaran 6-79 μmol.L-1 berfungsi sebagai penghambat dari penggunaan fluoranalog.
MOLEKUL KOMPLEKS MONOTERPENA SIKLASE
Kajian genetik yang berhasil dirampung oleh Bolhmann et al, (1998) sukses memetakan golongan senyawa terpena yakni Tpsa‒Tpsf. Baru-baru ini penelitian MEP dari Jones et al, (2008); Martin dan Bohlmann (2004); Lücker et al, (2002); Yang et al, (2005); Williams et al, (1998); Cane (1999); MacMillan dan Beale (1999); Wise dan Croteau (1999) yakni ke semua hasil cDNA SamonoTPS1, VVTPS, CLLS, CTGS merujuk pada Tpsb, karena memamerkan gen C10 untuk α-terpineol, limonene. Mereka menemukan untaian 323‒327 dan 34‒32 berperan sebagai aktivitas siklase yang kaya aspartat bercorak DDXXDD, serta gen reporter RRX8W berdasarkan sifat gugus bebas menunjukan ujung struktur primer protein ialah aminoterminus. Pemerisaan lanjutan menggunakan metode pemanjangan dan pemotongan klon cDNA memberikan fakta bahwa amino-terminus berfungsi sebagai perpindahan gugus pirofosfat untuk membuat tiga substrat
universal yakni C10, seskuiterpena/C15 (FPP), dan diterpena/C20 (GGPP) dalam biosintesis semua terpena. Oleh peneliti terdahulu Bolhmann et al, (1998); Lesburg et al, (1997); Tarshis et al, (1994); Williams et al, (1998) sepakat menyatakan corak tersebut membuktikan terdapat protein dengan tugas khusus, untuk semua terpena synthase mengionisasi gugus pirofsfat di substrat awal (3a) karena mengikat unsur Mn2+/Mg2+. Tapi gen-gen reporter tersebut tidak berlaku untuk semua sekuen protein cDNA C10‒synthase.
Rekayasa C10 dari hasil penelitian Lücker et al, (2002); Starks et al, (1997); Rynkiewics et al, (2001); Tarshis et al, (1994); Lesburg et al, (1997) menjelaskan pendayagunaan unsur logam amat substansial, karena sebagai pengaktif siklase. Ini dibuktikan dengan investigasi menyeluruh Citrus limonum, lebih menyukai Mn2+ dari pada Mg2+. Disamping itu efisiensi logam divalent/monovalent menjelaskan bahwa, fraksi Mn2+ berikatan dengan siklase meyebabkan perubahan aktivitas enzim disebabkan perubahan gugus alil karena kesalahan pengklonan gen Citrus limonum. Data-data kristalografi menunjukan struktur tiga dimensi polipeptida dari trichodiene-forming dan ophiobolin-F-forming menampakan kesamaan corak dengan SamonoTPS1 serta terdapat permukaan akti dari GPP untuk mengikat siklase dengan gaya yang relatif lemah untuk membentuk molekul kompleks dari GPP siklase. Penjabaran mengenai molekul C10 dapat disimpulkan bahwa terdapat kesamaan corak dan pemanfaatan senyawa logam.
PEMBAHASAN
Uraian molekuler C10 diatas Segel (1968); Chayet et al, (1984); Croteau (1986); Poulter et al, (1981) mencoba menjelakan mengenai siklase dari sisi mekanik, dengan memisalkan LPP, NPP, siklase, dan produk turunannya.
Ketika LPP terikat dengan siklase, maka membentuk suatu senyawa kompleks (LLP-siklase). Kemudian LPP-siklase di ikat oleh NPP sehingga membentuk prekursor
kompleks (pada gambar 3 yakni kompleksitas siklase mengikat LPP). Enzim kompleks berlaku sama untuk NPP. Lazimnya secara mekanik guna memperoleh senyawa turunan C10 yakni pertama-tama dengan menurunkan kecepatan reaksi (persamaan 1)
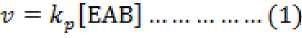
Siklaseterikatdengan ⅛∙⅛ Siklasemengikatsenyawa
Siklase ^===^? LPPSiklase senYawaJurunan1 , ' turunan ke 3 _
~ ~ Senyawa turunan ke 2 SenyawaturunankeA
NPP NPP
r.
LLP & NPP terikat denga siklase
Siklase mengikat
LLP & NPP
Kedua senyawa turunaπ~ bergabung dengan siklase
Senyawa turunan 3& di ikat oleh siklase
Gambar 3. Alur mekanika siklase guna menghasilkan keragaman C10. Ketrangan lainnya : konstanta disosiasi (KA, KB, αKA, αKB) dan tingkat kejenuhan LPP serta NPP (αKA (KmA) dan αKB (KmB) ) (Sumber : Segel, I.H. 1968)
Tahapan akhir yakni setelah LPP dan NPP berikatan dengan siklase, baik kecepatan reaksi, konstanta kesetimbangan, dan penurunan aktivitas enzim untuk sistem yang kompleks dapat dicari dengan persamaan (2).
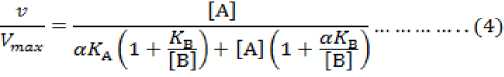
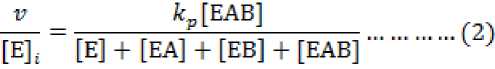
Karena setiap jenis siklase memiliki perbedaan sifat, maka terdapat perbedaan kosentrasi dalam sintesis C10. Untuk mencari nilai kosentrasi dapat diselesasikan dengan persamaan (3a).
Apabila yang dicari adalah nilai dari LPP, maka keceptan
NPP perlu diketahui dengan Vmax dan PP adalah tetapan konstanta [NPP]. Asalkan NPP = ∞ dan konstanta disosiasi = 0, maka dapat diselesaikan menggunakan persamaan (5).
_ [A]
'ζnαx ^ma0 p p + [A]
(5)
V
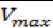
[A][B] a Ka Ke
[A] , [B] [A] [B]
............(3≡)
S
S
Bentuk lain dari persamaan (3a) yakni persamaan (3b)
Dengan catatan kecepatan maksimum berbanding lurus
dengan konstanta disosiasi produk di kali penghabatan
enzim :
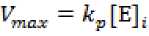
Pemecahan perbedaan kecepatan reaksi dari prekursor kompleks yakni persamaan (3) disusun menjadi persamaan (4).
SIMPULAN
Terobosan terbesar untuk memahami molekul C10 secara mendetail telah berhasil yakni dengan cara mengkonstruksi substrat asli sehingga mengahasilkan substrat analog. Rekayasa substrat analog sukses memproduksi berbagai senyawa C10 secara efisien, dan dengan dukungan kajian mekanika mampu menjelaskan kompleksitas multireaksi siklase. Sehingga para peneliti (yang berkecimpung dalam dunia sintesis C10) mengetahui apabila terjadinya kesalahan substrat/siklase dan mutasi pada tingkatan genetik. Walaupun terbosan begitu pesat, tapi di Indonesia belum sampai pada tingkatan molekuler dan genetik C10.
UCAPAN TERIMAH KASIH
Terima kasih kepada Kemendikbud atas bantuan dana guna melanjutkan studi magister.
KEPUSTAKAAN
Banerjee. A., T.D. Sharkey. 2014. Methylerythritol 4-phosphate (MEP) Pathway Metabolic Regulation (Review). Nat. Prod. Rep. 31:1043-1055.
Bolhmann. J., G. Meyer-Gauen., R. Croteau. 1998. Plant Terpenoid Synthases: Molecular Biology and
Phylogenetic Analysis. PNAS. 95:4126-4133.
Bouvier. F., C. Suire., A. dHarlingue., R.A. Backhaus., B. Camara. 2000. Moleculer Cloning of Geranyl Diphosphate Synthase and Compartmentation of Monoterpene Synthesis in Plant Cell. J. Plant. 24:241-252.
Burke. C., R. Croteau. 2002. Geranyl Diphosphate Synthase From Abies grandis: cDNA Isolation, Functional Expression, and Characterization. Arch. Biochem. Biophys. 405:130-136.
Cane. D. 1979. The Stereochemistry of Allylic Pyrophosphate Metabolism. Tetrahedron. 36:11091159.
Cane. D.E. 1999. Sesquiterpene Biosynthesis: Cyclization Mechanisms. In: Cane. D.E. (Ed.). Comprehensive Natural Products Chemistry: Isoprenoids, Including Carotenoids and Steroids. pp. 155-200. Pergamon Press: Oxford.
Cane. D.E., C. Abell., P.H.M. Harrison., B.R. Hubbard., C.T. Kane., R. Lattman., J.S. Oliver., S.W. Weiner. 1991. Terpenoid Biosynthesis and the Stereochemistry of Enzyme-Catalysed Allylic Addition Elimination Reactions. The Royal Society. 332:123-129.
Chayet. L., M.C. Rojas., O. Cori., C.A. Bunton., D.C. McKenzie. 1984. Complexes of Bivalent Cations with Neryl and Geranyl Pyrophosphate: Their Role in Terpene Biosynthesis. Bioor. Chem. 12:329-338.
Croteau. R. 1986. Evidence for the Ionization Steps in Monoterpene Cyclization Reactions Using 2-Fluorogeranyl and 2-Fluorolinalyl Pyrophosphates as Substrates. Arch. Biochem. Biophys. 251:777-782.
Croteau. R. 1987. Biosynthesis and Catabolism of Monoterpenoids. (Review). Am. Chem. Soc. 87:929954.
Croteau. R.B., E.M. Davis., K.L. Ringer., M.R. Wildung. 2005. (-)-Menthol Biosynthesis and Molecular Genetics (Review). Naturwissenschaften. 92:562– 577.
Devon, T.K., A.I. Scott.1972. Handbook of Naturally Occurring Compounds. Part 2 Terpenes. Academic Press. New York and London.
Dudareva. N., D. Martin., C.M. Kish., N. Kolosova., N. Gorenstein., J. Fäldt., B. Miller., J. Bohlmann. 2003. (E)-β-Ocimene and Myrcene Synthase Genes of
Floral Scent Biosynthesis in Snapdragon: Function and Expression of Three Terpene Synthase Genes of a
New Terpene Synthase Subfamily. Plant Cell. 15:1227-1241.
Dudareva. N., E. Pichersky., J. Gershenzon. 2004. Biochemistry of Plant Volatiles. Plant Physiol. 31:1043-1055.
Hofberger, J.A., A.M. Ramirez., E.V.D. Bergh., X. Zhu., H.J. Bouwmeester., R.C. Schuurink., M.R. Schranz. 2015. Large-Scale Evolutionary Analysis of Genes and Supergene Clusters from Terpenoid Modular Pathways Provides Insights into Metabolic Diversification in Flowering Plants. PLoS. One. 10:137.
Holloway. P.W., G. Popjak 1968. Isopentenyl Pyrophosphate Isomerase from Liver. J. Biochem. 106:835-840.
Hyatt. D.C., B. Youn., Y. Zhao., B. Santhamma., R.M. Coates., R.B. Croteau., CH. Kang. 2016. Structure of Limonene Synthase, a Simple Model for Terpenoid Cyclase Catalysis. PNAS. 104:5360-5365.
Jo Davisson. V., T.R. Neal., C.D. Poulter. 1985. Farnesyl Pyrophosphate Synthetase. A Case for Common Electrophilic Mechanisms for Prenyltransferases and Terpene Cyclases. J. Am. Chem. Soc. 107:5277-5279.
Jones, C.G., C.I. Keeling, E.L. Ghisalberti, E.L. Barbour, J.A. Plummer, J. Bohlmann. 2008. Isolation of cDNA and Fungsional Characterization of Two Multiproduct Terpene Enzymes from Sandalwood, Santalum album L. Arch. Biochem. Biophys. 477:121130.
Karp. F., Y. Zhao., B. Santhamma., B. Assink., R.M. Coates., R.B. Croteau. 2007. Inhibition of Monoterpene Cyclases by Inert Analogues of Geranyl Diphosphate and Linalyl Diphosphate. Arch. Biochem. Biophys. 468:140-146.
Lesburg. C.A., G. Zhai., D.E. Cane., D.W. Christianson. 1997. Crystal Structure of Pentalenene Synthase: Mechanistic Insights on Terpenoid Cyclization Reactions in Biology. Science. 277:1820-1824.
Lücker. J., M.K. El Tamer., W. Schwab., F.W.A. Verstappen., L.H.W. van der Plas., H.J. Bouwmeester., H.A. Verhoeven. 2002. Monoterpene Biosynthesis in Lemon (Citrus limon) cDNA Isolation and Functional Analysis of Four Monoterpene
Synthases. Eur. J. Biochem. 269:3160-3171.
MacMillan. J., M.H. Beale. 1999. Diterpene biosynthesis. In: Cane. D.E. (Ed.). Comprehensive Natural
Products Chemistry: Isoprenoids Including
Carotenoids and Steroids. pp. 217-243. Pergamon Press: Oxford.
Mahmoud, S.S., R.B. Croteau. 2002. Strategies for Transgenic Manipulation of Monoterpene
Biosynthesis in Plants (Review). Trends. Plant. Sci. 7:366-373.
Martin. D.M., J. Bohlmann. 2004. Identification of Vitis vinifera (-)-α-terpineol Synthase by in Silico Screening of Full-length cDNA ESTs and Functional Characterization of Recombinant Terpene Synthase. Phytochemistry. 65:1223-1229.
Ministry of Trade of Republic of Indonesia. 2011. Indonesian Essential Oil. The Scant of Natural Life. Handbook of Commodity Profile. Policy Analysis and Development Agency: Ministry of Trade Republic of Indonesia.
Noma. Y., Y. Asakawa. 2010. Biotransformation of Monoterpenoids. in Mander. L., H-W. Liu, (ed) Comprehensive Natural Products II: Chemistry and Biology, (9 ed.). pp. 669-801. Elsevier Ltd: Oxford.
Oyen, L.P.A., N.X. Dung. 1999. Plant Resources of SouthEast Asia. Part 19 Essential-oil plants. Backhuys: Netherlands.
Phillips. M.A., M.R. Wildung., D.C. Williams., D.C. Hyatt., R. Croteau. 2003. cDNA Isolation, Functional Expression, and Characterization of (+)-α-pinene Synthase and (-)-α-pinene Synthase from Loblolly pine (Pinus taeda): Stereocontrol in Pinene
Biosynthesis. Arch. Biochem. Biophys. 411:267–276.
Popjak. G., J.W. Cornforth., 1966. Substrate Stereochemistry in Squalene Biosynthesis. J. Biochem. 101:553-568.
Poulter, C.D., P.L. Wiggins., A.T. Le. 1981. Farnesyl Pyrophosphate Synthetase. A Stepwise Mechanism for the 1'-4 Condensation Reaction. J. Am. Chem. Soc. 103:3926-3927.
Poulter. C. D., H.C. Rilling. 1976. Prenyltransferase: The Mechanism of the Reaction. Biochemistry. 15:10791083.
Poulter. C.D., H.C. Rilling. 1978. The Prenyl Transfer Reaction. Enzymatic and Mechanistic Studies of the 1'-4 Coupling Reaction in the Terpene Biosynthetic Pathway. Am. Chem. Soc. 11:307-313.
Rodrȋguez-Concepción. M., A. Boronat. 2002. Elucidation of the Methylerythritol Phosphate Pathway for Isoprenoid Biosynthesis in Bacteria and Plastids. A Metabolic Milestone Achieved through Genomics. Plant. Physiol. 130:1079-1089.
Rohmer. M., M. Seemann., S. Horbach., S. Bringer-Meyer., H. Sahm. 1996. Glyceraldehyde 3-Phosphate and Pyruvate as Precursors of Isoprenic Units in an Alternative Non-mevalonate Pathway for Terpenoid Biosynthesis. J. Am. Chem. Soc. 118:2564-2566.
Rojas. M.C., L. Chayet., G. Portilla., O. Cori. 1983. Substrate and Metal Specificity in the Enzymic Synthesis of Cyclic Monoterpenes from Geranyl and Neryl Pyrophosphate. Arch. Biochem. Biophys. 222:389396.
Rynkiewics. M.J., D.E. Cane., D.W. Christianson. 2001. Structure of Trichodiene Synthase From
Fusariumsporotrichioides Provides Mechanistic Inferences on the Terpene Cyclisation Cascade. PNSA. 98:13543-13548.
Segel, I.H. 1968. Biochemical Calculations. How to Solve Mathematical Problems in General Biochemistry Second Edition. John Wiley and Sons. Inc. Canada.
Sharkey. T.D., A.E. Wiberley., A.R. Donohue. 2008. Isoprene Emission from Plants: Why and How (Invited Review). Annals. Botany. 101:5-18.
Starks. C.M., K. Back., J. Chappell., J.P. Noel. 1997. Structural Basis for Cyclic Terpene Biosynthesis by Tobacco 5-Epi-Aristolochene Synthase. Science. 277:1815-1820.
Tarshis. L.C., M. Yan., C.D. Poulter., J.C. Sacchettini. 1994. Crystal structure of Recombinant Farnesyl Diphosphate Synthase at 2.6-Å Resolution.
Biochemistry. 33:10871-10877.
Thulasiram. H.V., H.K. Erickson., C.D. Poulter. 2007. Chimeras of Two Isoprenoid Synthases Catalyze All Four Coupling Reactions in Isoprenoid Biosynthesis. Science. 316:73-76.
Williams. D.C., D.J. McGarvey., E.J. Katahira., R. Croteau. 1998. Truncation of Limonene Synthase Preprotein Provides a Fully Active ‘Pseudomature’ Form of This Monoterpene Cyclase and Reveals the Function of the Amino-Terminal Arginine Pair. Biochemistry. 37:12213-12220.
Wise. M.L., R. Croteau. 1999. Monoterpene biosynthesis. In: Cane. D.E. (Ed.). Comprehensive Natural
Products Chemistry: Isoprenoids Including
Carotenoids and Steroids. pp. 97-154. Pergamon Press: Oxford.
Yang. T., J. Li., H-X. Wang., Y. Zeng. 2005. A Geraniolsynthase Gene from Cinnamomum tenuipilum. Phytochemistry. 66:285-293.
Zhang. Q., K. Tiefenbacher. 2015. Terpene Cyclization Catalysed Inside a Self-assembled Cavity. Nature. Chem. 7:197-202.
90
Discussion and feedback