BIODIVERSITY OF SCLERACTINIAN CORAL AND REEF FISH AT PAPUMA BEACH, JEMBER, EAST JAVA
on
P ISSN: 1410-5292,
E ISSN: 2599-2856
JURNAL BIOLOGI UDAYANA22 (1): 13-24
KEANEKARAGAMAN KARANG KERAS DAN IKAN TERUMBU DI PANTAI PAPUMA JEMBER, JAWA TIMUR
BIODIVERSITY OF SCLERACTINIAN CORAL AND REEF FISH AT PAPUMA BEACH, JEMBER, EAST JAVA
Oktiyas Muzaky Luthfi1 dan Rendy Vidya Wibisono1 1 Ilmu Kelautan, Universitas Brawijaya, Malang, Indonesia, Email: omuzakyl@ub.ac.id
Diterima 23 Maret 2018 Disetujui 22 Mei 2018
INTISARI
Terumbu karang di Pantai Papuma dapat ditemukan pada kedalaman 3-20 m, dengan penyusun dasar perairannya adalah pasir. Terumbu karang di perairan Pantai Papuma sangat menarik untuk dipelajari lebih mendalam karena kondisi ekosistem pada perairan tersebut harus beradaptasi dengan lingkungan perairan yang ekstrim seperti laju sedimentasi tinggi, tingginya gelombang, derasnya arus dan resiko pengrusakan dari manusia. Tujuan dari penelitian ini adalah untuk melihat kondisi karang keras dan ikan terumbu di perairan Pantai Papuma secara deskriptif menggunakan data kuantitatif. Data karang diperoleh menggunakan metode line intercept transect 100 m untuk observasi karang keras yang dibentangkan tegak lurus dengan garis pantai, dan untuk observasi ikan terumbu digunakan metode underwater visual census sepanjang 100 m. Pengambilan data dilakukan di tiga stasiun penelitian: stasiun 1 (8°25'59.26"LS 113°33'15.07"BT), stasiun 2 (8°26'0.93"LS 113°33'17.53"BT) dan stasiun 3 (8°26'2.02"LS 113°33'20.06"BT) pada kedalaman 3-12 m. Bentuk pertumbuhan karang di Pantai Papuma
didominasi oleh karang bercabang (CB) dari genus Montipora dengan tutupan 30%, sedangkan substrat didominasi oleh pasir (SD) dengan tutupan 26.9%. Pada penelitian ini telah terhitung sebanyak 137 ekor ikan terumbu dengan 19% diantaranya merupakan ikan indikator (Chaetodontidae). Tingginya jumlah ikan indikator dapat dijadikan ukuran kesehatan terumbu karang di perairan Pantai Papuma.Tingginya tutupan karang hidup biasanya diikuti oleh jumlah ikan indikator yang tinggi pula. Ikan indikator termasuk ke dalam ikan pemakan karang (obligate corallivorous) yang selama siklus hidupnya memakan polip karang. Ada sebelas bentuk pertumbuhan terumbu karang di Pantai Papuma dengan tutupan karang hidup rata-rata adalah 39.9%.
Kata kunci: karang keras, Chaetodon, distribusi, Montipora, Selatan Jawa
ABSTRACT
Coral reef in Papuma was distributed in 3 to 20 m depth, with sand as main substrate. The coral reef was built from hard coral (scleractinian) and reef fishes. Papuma’s coral reef was interesting to be studied due to they can deal with the extreme environment such as high sand sedimentation, high wave, strong current, and anthropogenic risk. The purpose of this study was to descript distribution of hard coral and their fishes based on quantitative data in Papuma. We used Line Intercept Transect (LIT) method with 100 m long perpendicular with coast line to quantify of coral cover based on their life form. While reef fishes data was obtained using underwater visual census with 100 m long. All data was taken from 3 stasiun they were: station 1 (8°25'59.26"S 113°33'15.07"E), station 2 (8°26'0.93"S 113°33'17.53"E) and station 3 (8°26'2.02"S 113°33'20.06"E), in 3-12 m depth. The result showed that coral reef in Papuma was dominated by branching coral (CB) from genus Montipora with coral cover 30%, while sand (SD) to be main substrate with 26.9% of coverage. Montipora is one of genus famili Acroporidae that has faster growth than massive coral and strong branch as an adaptation strategy with strong current. In this research, we also found 137 of reef fishes that was 19% composed by indicator fish (Chaetodontidae). High number of indicator fish can represent of healthy coral reef. High coral cover coverage usually will be followed by increasing number of indicator fish. These fish were obligate corallivorous that consume coral polyp during their life. Coral reef in Papuma contained 10 types of life form and had coral cover about 39.9% in average.
Keywords: scleractinian coral, Chaetodon, distribution, Montipora, South Java
PENDAHULUAN
Papuma (113o33’11’’ BT – 8o25’48’’ LS) terletak 70 km arah Selatan dari Kota Jember yang merupakan salah satu gugusan dari The southern mountain zone yang dimulai dari daerah Karangsembung, Pacitan, Turen, dan Jember. Kawasan ini merupakan hasil patahan (fault) dari block yang memiliki tren pergerakan ke arah Timur Laut – Barat Daya dan Barat Laut – Tenggara (Smyth et al., 2003), sehingga substrat perairan di kawasan Selatan Jawa kaya akan pasir dan igneous rocks. Substrat pasir di pantai Papuma juga subur karena wilayah perairan ini dipengaruhi oleh salah satunya perputaran gelombang dan nutrien yang berasal dari down welling Kelvin yang membawa masa air hangat, selain itu pada sekitar Agustus akan terjadi upwelling yang membawa masa air dingin (Sprintall et al., 1999; Wyrtki, 1973). Dengan kondisi alamiah perairan Papuma yang memiliki substrat pasir dan memiliki nutrien tinggi namun karang keras dapat ditemukan berkembang di beberapa titik di perairan Papuma.
Secara umum, karang keras dapat hidup dengan optimal apabila hidup di atas substrat yang keras namun pada perairan Papuma, karang hidup di antara substrat pasir dan batuan gunung yang sangat mempengaruhi perkembangan dan pertumbuhan karang di perairan tersebut. Pengaruh sedimen dan substrat yang tidak stabil sangat berpengaruh terhadap juvenile karang dan larval dari berbagai telur ikan terumbu (Lecchiniet al., 2005). Ancaman juga berasal dari arus dan gelombang yang kuat sehingga akan membuat koloni karang pecah. Namun hal ini diduga juga akan mempercepat kolonisasi karang dengan cara aseksual, yakni pecahnya fragmen karang menjadi kecil-kecil yang kemudian akan menjadi koloni baru (Bowden-Kerby, 2001).
Perubahan biofisik yang terjadi pada karang akan mempengaruhi ekosistem didalamnya karena banyak biota laut yang berasosiasi dengan ekositem ini, termasuk ikan terumbu. Berkurangnya luasan karang akan mempengaruhi jumlah biota yang berlindung dan mencari makan di terumbu karang (Pratchett et al., 2006). Ikan terumbu sangat bergantung pada ekosistem terumbu karang yang penyusun utamanya
adalah karang keras (scleractinia) (Gratwicke dan Speight, 2005). Di perairan Indonesia tidak diketahui jumlah ikan terumbu secara pasti, namun diperkirakan mencapai 2057 species dari 113 famili. Sepupu famili dari karang terumbu sangat mendominasi perairan di Indonesia seperti Gobiidae (272 spesies), Labridae (178), Pomacentridae (152), Apogonidae (114), Blenniidae (107), Serranidae (102), Muraenidae (61), Syngnathidae (61), Chaetodontidae (59) and Lutjanidae (43) (Allen dan Adrim, 2013).
Lokasi dari Pantai Papuma berhadapan langsung dengan Samudera Hindia yang akan berdampak pada tingginya gelombang dan kencangnya arus di perairan tersebut, sehingga kedua alasan tersebut menjadi alasan utama tidak adanya aktivitas pariwisata di perairan ini. Namun kegiatan penangkapan ikan oleh nelayan tradisional masih dapat ditemukan. Kondisi alamiah inilah yang sebenarnya membawa dampak positif bagi terumbu karang di Pantai Papuma karena berkurangnya ancaman yang berasal dari manusia (antropogenik). Kerusakan terumbu karang akan berdampak pada berkurangnya spesies ikan hingga 75% dan jumlah ikan terumbu akan berkurang hingga 50% dari habitat alaminya (Jones et al., 2004). Terumbu karang dan ikan terumbu memiliki keterkaitan satu dengan yang lainnya, rusaknya ekosistem terumbu karang akan menghasilkan ketidak seimbangan pada alam.
Tujuan penelitian adalah untuk mengetahui tutupan hidup karang keras dan distribusi ikan terumbu yang berada di perairan Pantai Papuma yang dapat dijadikan sumber data keanekaragaman hayati di wilayah tersebut.
MATERI DAN METODE
Lokasi dan Waktu Penelitian
Penelitian dilakukan di Pantai Papuma, Desa Lojejer, Kecamatan Wuluhan, Kabupaten Jember, Jawa Timur pada tanggal 7 Juni dan 14 Juli 2016. Terumbu karang banyak ditemukan di sekitar Batu Malikan atau Utara Pulau Kodok, sehingga ditentukan 3 stasiun penelitian dimana stasiun 1 terletak pada 8°25'59.26"LS 113°33'15.07"BT; stasiun 2 pada 8°26'0.93"LS 113°33'17.53"BT dan stasiun 3 terletak pada 8°26'2.02"LS 113°33'20.06"BT (Gambar 1).
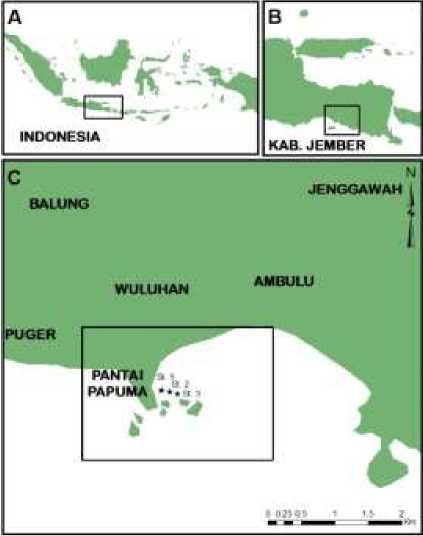
Gambar 1. Peta lokasi penelitian di Papuma, tanda bintang hitam adalah lokasi stasiun dimana survei dilakukan
Survei Terumbu Karang
Survei terumbu karang dilakukan pada kedalaman 510 m dengan SCUBA di tiga stasiun penelitian. Pengambilan data menggunakan lite intercept transect (LIT) yakni roll meter 100 m diletakkan di atas terumbu karang dengan arah tegak lurus dengan garis pantai (English et al., 1994). Kemudian dilakukan
perekaman data menggunakan underwater digital camera Canon G-16 (Japan) dengan cara mendokumentasikan setiap centimeter semua substrat di bawah roll meter. Data yang diperoleh dianalisis menggunakan Microsoft Excel 2016. Sedangkan untuk identifikasi karang hingga level genus digunakan metode Coral Finder (Kelly, 2009).
Survei Ikan Terumbu
Data ikan terumbu diambil menggunakan metode underwater visual census (UVC) yakni pengamatan ikan dilakukan sepanjang belt transect (panjang x lebar x tinggi) 100 x 6 x 6 m (Englishet al., 1994). Semua ikan yang berada di wilayah transek akan dicatat, jumlah, jenis dan ukuran ikan.
Tutupan Karang
Tutupan karang dihitung menggunakan rumus (1) di bawah ini (Englishet al., 1994):
P = 100% (1)
Dimana:
P = Persentase tutupan karang
i = Area karang dengan spesies i
A = Keseluruhan area tutupan
Indeks Ekologi
Indeks ekologi meliputi keanekaragaman jenis, keseragaman dan dominansi mengikuti rumus (2) berikut:
= -∑( ln ) (2)
H’ = Indeks keanekaragaman Shannon-Wiener
Pi = Perbandingan antara jumlah individu species kei (ni) dengan total individu (N).
i = 1,2,3.....n
Kemudian untuk mendapatkan nilai Indeks Keseragaman dan Dominansi dari kedua data, karang dan ikan terumbu dengan menggunakan rumus (3) dan (4) seperti berikut:
E^ (3)
Dimana: E = Indeks Keseragaman
H’= Indeks Keanekaragaman
S = Jumlah genus
D= ∑ ^1P^2 (4)
Dimana: D = Indeks dominansi
Pi = Perbandingan jumlah jenis dan total jenis
S = Jumlah lifeform/jenis yang ditemukan
HASIL
Tutupan Terumbu Karang di Pantai Papuma
Komposisi substrat di Pantai Papuma ada 11 jenis yang dibagi menjadi 2 yaitu biotik dan abiotik. Lima jenis substrat biotik yaitu acropora branching (ACB), coral branching (CB), coral foliose (CF), coral massive (CM), dan coral encrusting (CE), lima komponen lain adalah abiotik meliputi dead coral (DC), dead coral with algae (DCA), recently killed coral (RKC), rubble (Rb), sand (SD) dan lumpur (SI) (Gambar 2). Total karang ACB adalah 9,95%, karang bercabang (CB)
mendominasi di ketiga stasiun dengan total tutupan sebesar 81.45%. Substrat abiotik dengan tutupan relatif terbesar adalah pasir (SD) (St1=21,4%; St2=18,5% and St3=40,9%) (Gambar 2). Dead Coral with Algae dapat ditemukan pada semua stasiun dengan kisaran 4 – 13,6% (St2 – St1), recently killed coral berada pada kisaran 4,513,4% (St2-St3) dan pecahan karang atau rubble memiliki tutupan 9 – 12,3% (St2-St3). Lokasi stasiun sangat mempengaruhi tutupan karang hidup di Pantai Papuma, stasiun 1 dan 3 yang berbatasan langsung dengan substrat pasir memiliki tutupan karang hidup rendah yakni 38,7 dan 23,7%, sedangkan karang hidup di stasiun 2 lebih banyak yakni sebesar 57,5%. Sedangkan rerata kondisi terumbu karang di Pantai Papuma berada pada kondisi sedang (39,97%) (Gambar 3).
Indeks ekologi karang direpresntasikan pada 3 indeks yaitu Keanekaragaman (H’), Keseragaman (E) dan Dominansi. Keanekaragaman jenis karang terbesar ditemukan pada stasiun 3 sebesar 1,6 dengan tidak ada dominansi dari spesies tertentu (Tabel 2).
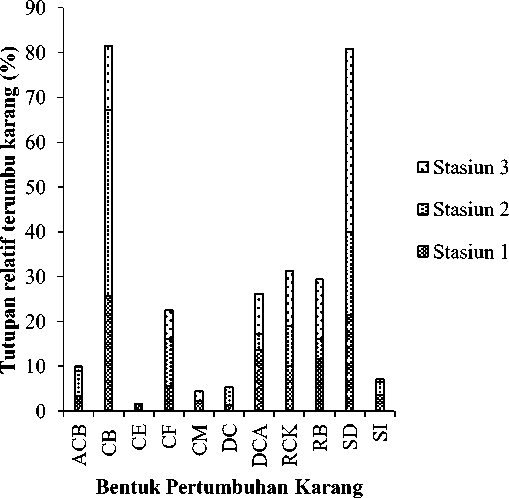
Gambar 2. Sebelas bentuk pertumbuhan karang yang menyusun terumbu karang di Pantai Papuma yang meliputi Acropora branching (ACB), coral branching (CB), coral foliose (CF), coral massive (CM), coral encrusting (CE), dead coral (DC), dead coral with algae (DCA), rock (RCK), rubble (Rb), sand (SD) dan silt (SI).
Ikan Terumbu di Pantai Papuma
Total ikan terumbu yang ditemukan selama survei di Pantai Papuma adalah 135 spesies ekor yang tersusun dari 28 genus dan 9 famili (Tabel 1). Kepadatan atau densitas ikan terumbu maksimal ditemukan pada stasiun 3 dengan
nilai 3360 individu/ha (Gambar 4). Ada empat famili ikan terumbu yang mendominasi di Pantai Papuma yaitu Acanthuridae (13 individu), Chaetodontidae (15 individu), Labridae (23 individu) dan Pomacentridae (76 individu)
(Gambar 5). Keanekaragaman spesies ikan terumbu diketiga stasiun tidak jauh berbeda dengan nilai keanekaragaman sedang dan juga tidak ada dominansi
spesies tertentu yang berada didalam ekosistem terumbu karang perairan Papuma (Tabel 2).
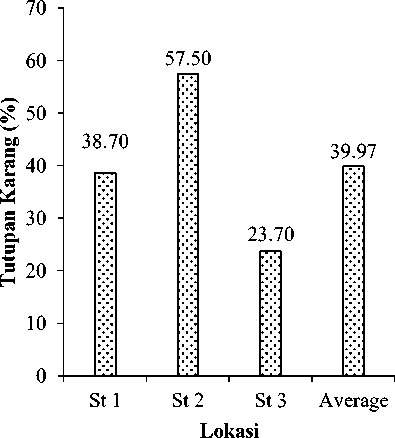
Gambar 3. Persentase tutupan karang hidup di perairan Pantai Papuma
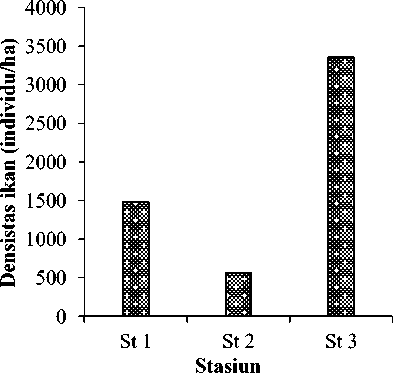
Gambar 4. Densitas ikan terumbu yang berada di terumbu karang Pantai Papuma
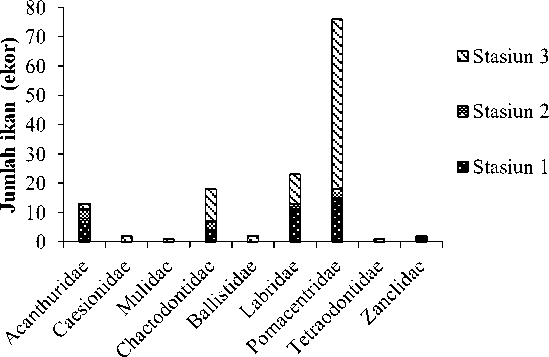
Famili
Gambar 5. Famili ikan terumbu hasil dari survei di Pantai Papuma
Tabel 1. Daftar ikan terumbu yang berasosiasi di terumbu karang di Pantai Papuma
|
Famili / Spesies |
St 1 |
St 2 |
St 3 |
Total |
|
Acanthuridae Ctenochaetus striatus |
6 |
3 |
- |
9 |
|
Zebrasoma scopas |
- |
2 |
2 |
4 |
|
Caesionidae Caesio cuning |
- |
- |
2 |
2 |
|
Mulidae Parupeneus barberinus |
- |
- |
1 |
1 |
|
Chaetodontidae Chaetodon baronessa |
1 |
- |
- |
1 |
|
C. kleinii |
1 |
2 |
- |
3 |
|
C. decussatus |
- |
- |
1 |
1 |
|
C. ephippium |
- |
1 |
- |
1 |
|
C. trifasciatus |
2 |
- |
6 |
8 |
|
Heniochus varius |
- |
- |
1 |
1 |
|
Ballistidae £ Melichtthys indicus S Labridae 2 Chellinus oxycephalus Coris batuensis g Halichoeres chrysus H. vrolikii Gomphosus caeruleus |
- |
- |
2 |
2 |
|
1 |
1 |
- |
2 | |
|
5 |
- |
2 |
7 | |
|
- |
- |
2 |
2 | |
|
1 |
- |
- |
1 | |
|
3 |
- |
3 |
6 | |
|
Labroides dimidiatus |
- |
- |
1 |
1 |
|
Pseudocheilinus hexataenia |
- |
1 |
- |
1 |
|
Thalassoma lunare |
1 |
- |
2 |
3 |
|
Pomacentridae Amblyglyphydodon tematensis |
- |
- |
3 |
3 |
|
Abudefduf vaigiensis |
1 |
- |
- |
1 |
|
Plectoglypidodon dickii |
9 |
3 |
17 |
29 |
|
Dasycyllus cameus |
- |
- |
30 |
30 |
|
D. trimaculatus |
5 |
- |
3 |
8 |
|
Pomacentrus vaiuli |
- |
- |
2 |
2 |
|
P. moluccensis |
- |
- |
3 |
3 |
|
Tetraodontidae Canthigaster papua |
- |
- |
1 |
1 |
|
Zanclidae Zanclus cornutus |
1 |
1 |
- |
2 |
|
Total |
135 |
Tabel 2. Indeks ekologi ikan terumbu dan karang di perarain Pantai Papuma
|
Stasiun |
H' |
E |
Ikan |
C Karang | ||
|
Ikan |
Karang |
Ikan |
Karang | |||
|
1 |
2,22 |
1,37 |
0,87 |
0,76 |
0,14 |
0,32 |
|
2 |
1,97 |
1,22 |
0,95 |
0,88 |
0,15 |
0,33 |
|
3 |
2,24 |
1,60 |
0,76 |
0,89 |
0,18 |
0,24 |
|
Ket. H’: Indeks Keanekaragaman; E: Indeks Keseragaman; C: Indeks Dominansi | ||||||
PEMBAHASAN
Kondisi Umum Perairan
Pantai Papuma secara administatif berada di Desa Lojejer Kecamatan Wuluhan Kabupaten, Jember.Pantai Papuma tersusun atas batuan karang (calcareous) dan batuan gunung (andesite) sehingga termasuk dalam kategori pantai berbatu (rocky shore) dimana secara geologi daerah Selatan Jember termasuk dalam konstalasi dari The southern mountain zone yang diperkirakan terbentuk pada awal hingga pertengahan Miocene (Soeria-Atmadja et al., 1994; Smyth et al., 2003). Substrat di Pantai Papuma terdiri dari pecahan batuan karang yang terdeformasi menjadi pasir (calcareous) dengan warna putih, endapan lempung (terrigenous) hasil dari endapan sedimen daratan, batuan vulkanik (andesite) dengan warna hitam, batuan bresia (breccia) dan pasir yang berasal dari pecahan foraminifera, karang dan invertebrata bercangkang lainnya.
Kondisi oseanografi perairan Pantai Papuma sangat dipengaruhi oleh adanya pola angin, yang secara umum berdampak kepada jumlah air hujan yang masuk ke dalam laut. Pada musim barat atau muson barat (Oktober-Februari) akan banyak membawa air hujan disertai angin kencang, yang akan mempengaruhi salinitas, kecerahan, arus dan gelombang perairan Pantai Papuma, sedangkan ketika musim timur (April-Agustus) perairan akan lebih tenang, dengan curah hujan yang lebih sedikit dibandingkan dengan musim barat. Masa teduh atau gelombang relatif kecil terjadi di masa peralihan I (Maret-April) dan II (September-Oktober) dimana pada masa ini posisi matahari berada di khatulistiwa yang menyebabkan angin melemah dengan arah tidak menentu (Yananto dan Sibarani, 2016).
Tutupan Terumbu Karang
Ada 2 spesies karang yang memiliki bentuk pertumbuhan bercabang (CB) di parairan Papuma yaitu Montipora digitata dan Seriatopora hystrix. M. digitata tergolong famili Acroporidae dengan ciri khas koloni yang berbentuk seperti tangan (digitate) atau terkadang koloninya berbentuk seperti percabangan
pohon (arborescent). Karang ini mengalami polymorphism (memiliki banyak bentuk pertumbuhan) yakni yellow spatulate (YS) dan fat finger (FF). YS memiliki warna hijau kekuningan dengan ujung cabangnya berbentuk pipih sedangkan FF memiliki warna coklat keunguan dengan ujung percabangannya membulat (Veron, 2000; Stobart, 2000).
Keberhasilan dominansi M. digitata di perairan Papuma dibandingkan dengan karang spesies lainnya dapat dianalisis dari sistem reproduksi yang dimiliki. M. digitata memiliki sistem reproduksi secara seksual dengan mode spawner atau melepaskan telur dan sperma dalam waktu bersamaan sehingga akan terjadi pembuahan di luar dalam kurun waktu 24 jam. Setiap polip biasanya akan mengeluarkan sebanyak 11 telur dalam kurun 3 hari. Setelah pembuahan terjadi maka terbentuk planula yang akan mengalami fase melayang-layang di kolom air (planktonic) selama 3-7 hari yang kemudian planula tersebut akan dapat menemukan substrat yang cocok untuk ditempati (Heyward dan Collins, 1985; McGehee, 1994).
Perkembangan secara aseksual karang antara lain dengan cara fragmentasi, yang didefinisikan sebagai sebagian koloni yang masih hidup dan terpisah secara fisik dari koloni induknya yang disebabkan karena pecahnya skeleton (kerangka) dari koloni asal. Fragmentasi ini merupakan mode dari reproduksi aseksual karang yang tujuannya adalah menambah koloni baru secara independent sehingga memperbanyak jumlah dan koloni karang secara cepat. Hal ini berbeda dengan sistem reproduksi aseksual budding, yaitu reproduksi aseksual dengan mengkloning jumlah polip di dalam sebuah koloni karang (extra-tentacular budding) atau satu polip yang membelah diri (intra-tentacular budding) (McGehee, 1994).
Karang M. digitata dapat bertahan hidup pada kondisi arus deras dan keruh dan terkadang menjadi spesies dominan dengan cara memperbanyak diri dengan fragmentasi secara alamiah (Heyward dan Collins, 1985). Pada program Reef Rehabilitation di Filipina sebelah Utara pada tahun 2011 telah digunakan metode fragmentasi M. digitata sebagai karang transplan di dua lokasi berbeda. Ada dua lokasi yang telah ditentukan sebagai tempat rehabilitasi karang tersebut adalah Binlab dan Malilnep Ac, dimana terumbu karang di kedua lokasi
tersebut telah rusak yang disebabkan oleh badai taifun yang selalu datang setiap tahunnya dan juga laju sedimentasi yang tinggi serta praktek blast fishing yang masing banyak dilakukan oleh nelayan. Hasil dari kegiatan tersebut menunjukkan kecepatan pertumbuhan karang M. digitata di Malilnep Ac adalah 3.1 ± 0.1 hingga 8.2 ± 1.7 mm 30 hari-1. Sedangkan di Binlab pertumbuhan karang M. digitata pada rentang 0.8 ± 0.0 - 5.8 ± 0.0 mm 30 hari-1 (Gomezet al., 2011).
Secara alamiah karang M. digitata yang termasuk dalam famili Acroporidae memang memiliki pertumbuhan yang cepat, sehingga wajar apabila di Pantai Papuma jenis karang ini ditemukan lebih dominan dibandingkan dengan karang yang lain (Heyward dan Collins, 1985). Kesuksesan pertumbuhan karang ditentukan oleh faktor biologi dan faktor lingkungan. Faktor biologi adalah faktor genetis dari hampir semua Acroporidae memiliki pertumbuhan yang sangat cepat, hal ini dikarenakan semua Acroporiids memiliki struktur kerangka yang efisien yakni dengan membentuk synapticular mode (rongga kapur berbentuk melengkung seperti huruf U) sehingga mereka hanya butuh sedikit kalsium karbonat dalam pembentukan kerangka tubuhnya (Luthfi et al., 2016). Faktor lingkungan yang mempengaruhi pertumbuhan karang M. digitata di parairan Pantai Papuma adalah ombak dan arus yang deras sebagai ciri khas laut Selatan Jawa. Kondisi ini selain menjadi faktor pembatas pertumbuhan karang, juga berfungsi sebagai pengatur nutrisi dari alam ke karang, pengatur kandungan dissolved oxygen di dalam perairan hingga tetap stabil, penghilang sedimen pasir yang menutupi polip karang, penghilang sampah yang mungkin melekat pada koloni karang dan membantu menyebarkan larva atau planula karang (Madin et al., 2006).
S. hystrix memiliki percabangan sangat kecil dengan ujung yang runcing, diameter cabang berukuran 1.2 – 10 mm. Sudut percabangan sangat bervariasi, yang dimungkinkan karena perbedaan tahapan pertambahan cabang. Koloni hidupnya memiliki warna pink, hijau, biru atau krem (Veron, 2000; Dai dan Horng, 2009). Hampir semua famili Pocilloporidae memiliki sistem reproduksi seksual tipe brooder, dan di Indonesia (tropis) reproduksi ini dilakukan setiap bulan dari tanggal 1 hingga tanggal 10/13 kalender bulan. Reproduksi dimulai dari pukul 18.00 hingga pukul 02.00 dini hari. Di Great Barrier Reef Australia S. hystrix hanya melakukan reproduksi pada saat musim panas dan mengikuti periode bulan (lunar periodicity) (Tanner, 1996). Pola reproduksi karang S. hystrix di Filipina juga menunjukkan perbedaan dengan di Indonesia. Menurut Villanueva et al. (2008),
S. hystrix melakukan reproduksi pada seperempat bulan terakhir pada hitungan kalender bulan.
Planula karang akan mengalami masa diaspora setelah dikeluarkan dari induknya selama kurang lebih 100 hari (Harii et al., 2002). Kemudian secara alamiah planula tersebut akan memancarkan semacam senyawa kimia (chemical cues) untuk mencari substrat yang cocok untuk ditempeli (settlement) hingga terbentuk koloni baru. Planula memiliki kemampuan untuk memilih substrat yang cocok diantaranya adalah memilih substrat yang stabil, tidak ada kompetitor (alga, sponge atau karang lain), ketersediaan cahaya matahari, salinitas, pergerakan air, kedalaman dan sedimentasi. Bahan kimia tersebut disebut sebagai G-protein-coupled receptors (GPCRs) dan asosiasinya (AC/cAMP atau PI/DAG/PKC) (Bosch et al., 2012). Beberapa usaha restorasi yang
dilakukan oleh peneliti agar planula karang dapat menempel pada substrat alamiahnya adalah mengikat pecahan karang (rubble) dengan jarring. Metode ini ternyata sangat efektif dilakukan untuk rehabilitasi karang di Taman Nasional Komodo (Fox et al., 2005). Dengan kondisi di perairan Pantai Papuma yang didominasi oleh substrat pasir, tentu memiliki konsekuensi yang kurang baik bagi pertumbuhan dan perkembangan planula karang S. hystrix. Pasir memiliki sifat tidak stabil apabila terkena ombak atau arus, juga akan mempengaruhi turbiditas perairan sehingga akan menghalangi masuknya sinar matahari ke dalam perairan dan akan mengurangi laju fotosintesa karang. Alasan tersebut diatas memungkinkan mengapa jumlah koloni S. hystrix sangat sedikit di perairan Pantai Papuma.
Tutupan Karang
Gambar 3 menunjukkan perbedaan tutupan karang hidup di tiga stasiun yang ada. Setiap stasiun merepresentasikan jumlah karang hidup relatif dibandingkan dengan total panjang keseluruhan substrat dasar yang ada di setiap stasiun. Berdasarkan Gambar 2, tidak semua bentuk pertumbuhan karang dapat ditemukan di Pantai Papuma karena memang dominasi pasir dan arus serta gelombang menjadi faktor pembatas utama untuk pertumbuhan karang di perairan tersebut. Gambar 2 juga menunjukkan bahwa karang dengan bentuk pertumbuhan merayap (CE) hanya dapat ditemukan pada stasiun 1 dengan tutupan kecil sekali yakni sebesar 1.6%. Karang dengan bentuk pertumbuhan merayap bisa diartikan pada beberapa hal, pertama, merayap adalah bentuk pertumbuhan awal dari fase juvenile sebelum karang tersebut dewasa, bisa jadi setelah dewasa karang akan memiliki bentuk pertumbuhan lain. Contoh dari spesies karang yang memiliki bentuk pertumbuhan ini adalah
Montipora verrucosa dimana pada masa awal pertumbuhan karang ini akan merayap dan ketika dewasa akan berbentuk sub massive, column atau laminar (Veron, 2000). Kedua, bentuk pertumbuhan merayap yang menjadi karakter dari karang tersebut dari fase juvenile hingga dewasa, contohnya adalah Isopora crateriformis yang tetap memiliki bentuk pertumbuhan dari juvenile hingga dewasa (Veron, 2000).
Kehidupan karang keras dapat dipengaruhi oleh bentuk atau struktur dari kerangka kapur karang serta kekuatan karang terhadap kuatnya gelombang dan arus laut. Oleh karena itu, karang harus tunduk terhadap teori hidrodinamika dan harus memiliki strategi agar tahan terhadap tekanan lingkungan. Beberapa strategi karang untuk menghadapi lingkungan seperti di Pantai Papuma diantaranya adalah: (1) mengurangi ukuran percabangan dan merubah bentuk pertumbuhan menjadi massive atau encrusting; (2) mengubah arah atau orientasi percabangan. Strategi pertama biasa dilakukan oleh Pocillopora, Montipora, Acropora, dan Millepora, sedangkan strategi kedua biasa dilakukan oleh Acroporids coral (Graus et al., 1977).
Lingkungan yang kurang nyaman untuk tujuan wisata air membuat kegiatan wisata di Pantai Papuma hanya terkonsentrasi di darat atau hingga daerah intertidal dimana tidak ada karang yang tumbuh di daerah ini. Bukti kerusakan ekosistem terumbu karang akibat kegiatan pariwisata diantaranya pembangunan pemukiman di jalur hijau, peningkatan sedimentasi ke air laut, perusakan (menginjak atau menendang) karang saat menyelam atau snorkeling, pecahnya karang karena terkena jangkar, limbah buangan domestik yang meningkatkan kandungan nutrien pada air laut, hilangnya ikan-ikan terumbu tertentu karena dipancing dan penggunaan bahan kimia untuk menangkap ikan (Sunlu, 2003). Kegiatan pariwisata di ekosistem terumbu karang juga dapat meningkatkan prevalensi penyakit karang di Thailand (Lamb et al., 2014). Dan tentunya peningkatan jumlah penyakit akan meningkatkan potensi kematian pada karang keras di suatu wilayah.
Ikan Terumbu di Pantai Papuma
Famili Acanthuridae memiliki banyak sinonim seperti Surgeonfishes, tangs, unicornfishes atau terkenal dengan nama surgeonfish saja, karena semua famili dari ikan ini memiliki satu atau dua duri tajam (mirip pisau bedah) yang berada di ekornya. Ikan ini tersebar luas di kawasan Indo-Pasifik dan hidup di daerah reef flat, laguna dan lereng terumbu hingga kedalaman 30 m. Ikan ini sering ditemukan juga di daerah pecahan karang dan substrat berbatu (Randall
dan Clements, 2001). Berdasarkan data fish base, famili ini memiliki 6 genus dan 82 spesies. Pada pada penelitian ini hanya ditemukan 2 spesies yaitu Ctenochaetus striatus dan Zebrasoma scopas. C. striatus disebut juga Striped Bristletooth, Bristle-toothed Surgeonfish, Orange-dotted Bristletooth, Striated Surgeonfish, Lined Bristletooth atau di Indonesia disebut juga sebagai “dodoh long” (Randall dan Clements, 2001; May, 2005). C. striatus memiliki kebiasaan memakan detritus pada epilithic algal matrix (EAM) sehingga mampu memindahkan sedimen sebanyak 28.6 ± 6.2 kg 100 m2 per tahun dan sebanyak 36.5% sedimen dipindahkan dari atas terumbu ke bawah terumbu (Goatley dan Bellwood, 2010). Spesies lain dari Acanthuridae yang ditemukan adalah Zebrasoma scopas, ikan ini ditemukan di stasiun 2 dan 3 dengan jumlah total 4 ekor. Zebrasoma scopas memiliki kebiasaan bergerombol (schooling) hingga 20 ekor, tapi ketika masa juvenile kebanyakan dari ikan ini bersifat soliter. Sama halnya dengan aggota Acanthuridae yang lain, ikan ini memakan makro alga dan filamentous alga (Kuiter dan Tonozuka, 2001; Guiasu dan Winterbottom, 1998).
Famili ikan terumbu yang lain adalah Chaetodontidae, yang secara global memiliki 12 genus dan 129 spesies (fishbase.org). Ikan ini juga disebut ikan sebagai butterflyfish atau ikan kepe-kepe. Hampir semua famili ini memiliki warna cerah dengan ciri ada garis hitam di mata. Umumnya ikan dari famili Chaetodontidae adalah pemakan polip dan tentakel karang, invertebrata kecil, telur ikan dan filamentaous alga (Nelson, 1994). Berdasarkan pola makan, ikan ini dibagi menjadi 3 yaitu 1. Obligate coral feeder dimana ikan ini hanya mengkonsumsi karang. 2. Facultative coral feeder yakni apabila ikan ini memakan karang sebagai makanan utama dan terkadang memakan invertebrata yang ada di karang sebagai makanan tambahan. 3. Non-coral feeder, yakni ikan yang jarang mengkonsumsi karang (Pratchett, 2007). Ada 2 jenis ikan terumbu yang ditemukan di perairan Pantai Papuma yang bersifat obligate coral feeder yaitu Chaetodon kleinii dan C. trifasciatus. C. kleinii sangat tergantung pada tutupan karang hidup terutama pada karang Acropora dan Pocillopora damicornis karena ikan jenis obligate feeder (Pratchet et al., 2006; Pratchett, 2007). C. trifasciatus memakan banyak karang jenis Acropora, secara spesifik adalah A. clathrata yang berbentuk meja dan A. formosa yang memiliki bentuk pertumbuhan bercabang. Beberapa penelitian juga menunjukkan ikan C. trifasciatus memiliki daerah kekuasaan atau feeding territorial sepanjang 10,56 ± 2,33 m (Samways, 2005).
Famili Labridae atau disebut wrasses memiliki genus sebanyak 71 dan 524 spesies. Ukuran wrasses sangat bervariasi antara 20 cm – 2.5 m. Ciri khas dari ikan ini adalah warna yang mencolok (dominan biru) dan
memiliki bibir yang tebal, selain itu wrasses memiliki jenis mulut yang mampu maju ke depan atau disebut sebagai protactile mouths. Beberapa jenis ikan dari Labridae sangat terkenal seperti humphead wrasse (Cheilinus undulatus) yang sudah dilindungi keberadaannya karena terancam punah. Di perairan Pantai Papuma ditemukan 8 spesies dari Labridae diantaranya Coris batuensis yang merupakan endemik di Samudra Hindia. Spesies ini banyak ditemukan di daerah terumbu karang dengan kedalaman dari 2 hingga 30 m (fishbase.org). C. batuensis memakan berbagai jenis makanan seperti Annelida, Moluska, Arthropoda dan Cnidaria. Berdasarkan pembedahan pada lambung ikan ini, jenis makanan yang paling banyak dikonsumsi adalah famili Dialidae (gastropoda) (Muñoz dan Cribb, 2006).
Gomphosus caeruleus adalah spesies terbanyak kedua ditemukan di perairan Papuma. Warna ikan ini biru hingga coklat dengan mulut moncong mirip burung sehingga disebut sebagai greenbirdmouth wrasse. Kebanyakan dari ikan ini hidup soliter di perairan dengan tutupan karang tinggi dan dangkal serta perairan berbatu (Sommer et al., 1996). Makanan utama ikan ini adalah invertebrata kecil (Gomon dan Randall, 1984). Karang keras sangat penting bagi perkembangan ikan ini karena waktu juvenile jenis ikan ini dihabiskan pada karang Acropora austere (Floros dan Schleyer, 2016).
Anggota famili Labridae yang mendominasi perairan Pantai Papuma yang lain adalah moon wrasse (Thalassoma lunare) yang merupakan ikan asli dari Samudera Hindia dan Samudera Pasifik. Pada usia dewasa, ukuran ikan dapat mencapai panjang hingga 45 cm. Ikan ini hidup di daerah terumbu karang dan perairan yang memiliki substrat batuan dari kedalaman 1 m hingga 25 m (Bernardi et al., 2004). T. lunare aktif mencari ikan di siang hari. Namun, karena penglihatannya yang tajam, jenis ikan ini mampu mencari mangsanya hingga tengah malam. Mangsa dari ikan ini adalah juvenil ikan yang hidup pada karang dengan lifeform corymbosa (Holmes et al., 2012). Keberadaan ikan labrid termasuk T. lunare sangat dipengaruhi kompleksitas substrat dasar perairan dan kedalaman, sedangkan sebaran labrid tidak dipengaruhi oleh bentuk morfologi karang yang menjadi habitat alaminya (Nanami et al., 2005).
SIMPULAN
Tutupan karang hidup di perairan Papuma adalah 39.97% atau tergolong sedang, dimana faktor alamiah lingkungan dengan substrat pasir menjadi faktor pembatas utama pertumbuhan karang hidup diperairan ini. Sedangkan jumlah ikan terumbu yang ditemukan
diperairan ini adalah 135 spesies dengan dominansi dari Famili Pomacentridae. Jumlah ikan indicator (Chaetodontidae) yang berjumlah 15 ekor dapat mengindikasikan hubungan yang erat antara tutupan karang hidup dengan jumlah ikan yang tergantung pada karang (corallivorous).
KEPUSTAKAAN
Allen, Gerald R., and Mohammed Adrim. 2003. Coral reef fishes of Indonesia. Zoological Studies 42(1): 172.
Bernardi, G., Bucciarelli, G., Costagliola, D., Robertson, D.R. and Heiser, J.B., 2004. Evolution of coral reef fish Thalassoma spp.(Labridae). 1. Molecular phylogeny and biogeography. Marine Biology 144(2): 369-375.
Bosch, T.C., Adamska, M., Augustin, R., Domazet‐Loso, T., Foret, S., Fraune, S., Funayama, N., Grasis, J., Hamada, M., Hatta, M. and Hobmayer, B. 2014. How do environmental factors influence life cycles and development? An experimental framework for early‐ diverging metazoans. Bioessays 36(12): 1185-1194.
Bowden-Kerby, A., 2001. Low-tech coral reef restoration methods modeled after natural fragmentation processes. Bulletin of Marine Science 69(2): 915-931.
Dai, C.F., and Horng S. 2009.Scleractinia fauna of Taiwan. II. The robust group. National Taiwan University, Taipei.
English, S.S., Wilkinson, C.C. and Baker, V.V. 1994. Survey manual for tropical marine resources. Australian Institute of Marine Science (AIMS).
Floros, C. and Schleyer, M.H. 2016.The functional importance of Acropora austera as nursery areas for juvenile reef fish on South African coral reefs.Coral Reefs.pp.1-11.
Fox, H.E., Mous, P.J., Pet, J.S., Muljadi, A.H. and Caldwell, R.L. 2005.Experimental assessment of coral reef rehabilitation following blast fishing. Conservation Biology 19(1): 98-107.
Goatley, C.H. and Bellwood, D.R. 2010. Biologically mediated sediment fluxes on coral reefs: sediment removal and off-reef transportation by the
surgeonfish Ctenochaetus striatus. Marine Ecology Progress Series 415: 237-245.
Gomez, E.D., Yap, H.T., Cabaitan, P.C. and Dizon, R.M. 2011.Successful transplantation of a fragmenting coral, Montipora digitata, for reef rehabilitation. Coastal Management 39(5): 556-574.
Gomon, M.F. and J.E. Randall, 1984.Labridae.In W. Fischer and G. Bianchi (eds.) FAO species identification sheets for fishery purposes.Western Indian Ocean fishing area 51.Vol. 2.
Gratwicke, B., and M. R. Speight. 2005. "The relationship between fish species richness, abundance and habitat complexity in a range of shallow tropical marine habitats." J.of fish biology 66(3): 650-667.
Graus, R.R., Chamberlain Jr, J.A. and Boker, A.M. 1977. Structural Modification of Corals in Relation to Waves and Currents: Reef Biota.
Guiasu, R.C. and R. Winterbottom. 1998. Yellow juvenile color pattern, diet switching and the phylogeny of the surgeonfish
genus Zebrasoma (Percomorpha, Acanthuridae). Bull. Mar. Sci. 63(2):277-294.
Harii, S., Kayanne, H., Takigawa, H., Hayashibara, T. and Yamamoto, M. 2002.Larval survivorship, competency periods and settlement of two
brooding corals, Heliopora coerulea and Pocillopora damicornis. Marine biology 141(1): 3946.
Heyward, A. J., and J. D. Collins. 1985. Growth and sexual reproduction in the scleractinian coral Montipora digitata (Dana). Australian Journal of Marine and Freshwater Research 36: 441–446.
Holmes, T.H., Wilson, S.K., Vanderklift, M., Babcock, R. and Fraser, M. 2012.The role of Thalassoma lunare as a predator of juvenile fish on a subtropical coral reef. Coral Reefs 31(4): 1113-1123.
Jones, Geoffrey P., Mark I. McCormick, Maya Srinivasan, and Janelle V. Eagle. 2004. "Coral decline threatens fish biodiversity in marine reserves." Proceedings of the National Academy of Sciences of the United States of America 101(21): 8251-8253.
Kelly, R. 2009. Coral Finder Indo Pasific. The Australian Coral Reef Society. Townsville, Australia.
Kuiter, R.H. and T. Tonozuka. 2001. Pictorial guide to Indonesian reef fishes. Part 3. Jawfishes -Sunfishes, Opistognathidae - Molidae. Zoonetics, Australia p. 623-893.
Lamb, J.B., True, J.D., Piromvaragorn, S. and Willis, B.L. 2014. Scuba diving damage and intensity of tourist activities increases coral disease prevalence. Biological Conservation 178: 88-96.
Lecchini, D., Shima, J., Banaigs, B. and Galzin, R. 2005. Larval sensory abilities and mechanisms of habitat selection of a coral reef fish during settlement. Oecologia 143 (2): 326-334.
Luthfi, O.M., Andik I., and Sari, EJ. 2016. Dominance of Acroporids Coral in Coral Reef of Bali Strait, Indonesia. Proceeding of the 6th Annual Basic Science International Conference 173-178 pp.
Madin, J. S., K. P. Black, and S. R. Connolly. 2006. Scaling water motion on coral reefs: from regional to organismal scales. Coral Reefs 25:635–644.
May, D. 2005.Folk taxonomy of reef fish and the value of participatory monitoring in Wakatobi National Park, southeast Sulawesi, Indonesia. SPC Traditional
Marine Resource Management and Knowledge
Information Bulletin 18: 18-35.
McGehee, M.A. 1994. Correspondence between assemblages of coral reef fishes and gradients of water motion, depth, and substrate size off Puertoe Rico. Marine Ecology-Progress Series 105: 243-243.
Muñoz, G. and Cribb, T.H. 2006. Parasite communities and diet of Coris batuensis (Pisces: Labridae) from Lizard Island, Great Barrier Reef. Memoirs of the Queensland Museum 52(1): 191-198.
Nanami, A., Nishihira, M., Suzuki, T. and Yokochi, H. 2005.Species-specific habitat distribution of coral reef fish assemblages in relation to habitat characteristics in an Okinawan coral
reef. Environmental Biology of Fishes 72(1): 55-65.
Nelson, J.S. 1994. Fishes of the world. Third edition. John Wiley & Sons, Inc., New York. 600 p.
Pratchett, M. S., S. K. Wilson, and A. H. Baird. 2006. "Declines in the abundance of Chaetodon butterflyfishes following extensive coral
depletion." J. of Fish Biology 69 (5): 1269-1280.
Pratchett, M.S. 2007. Dietary selection by coral-feeding butterflyfishes (Chaetodontidae) on the Great Barrier Reef, Australia. Raffles Bull Zool 14: 171-176.
Randall, J.E and K.D. Clements. 2001. Second revision of the surgeonfish genus Ctenochaetus (Perciformes: Acanthuridae), with descriptions of two new species. Indo-Pac. Fish 32:33 p.
Samways, M.J. 2005. Breakdown of butterflyfish (Chaetodontidae) territories associated with the onset of a mass coral bleaching event. Aquatic Conservation: Marine and Freshwater Ecosystems 15(S1): S101-S107.
Smyth, Helen, Robert Hall, Joseph Hamilton, and Peter Kinny. 2003. "Volcanic origin of quartz-rich sediments in East Java." Pp. 1-19.
Soeria-Atmadja, R., Maury, R.C., Bellon, H., Pringgoprawiro, H., Polve, M. and Priadi, B., 1994.Tertiary magmatic belts in Java. J. of Southeast Asian Earth Sciences 9 (1-2): 13-27.
Sommer, C., W. Schneider and J.-M. Poutiers. 1996. FAO species identification field guide for fishery purposes. The living marine resources of Somalia. FAO, Rome. 376 p.
Sprintall, Janet, Jackson Chong, Fadli Syamsudin, Werner Morawitz, Susan Hautala, Nan Bray, and Susan Wijffels. 1999. "Dynamics of the South Java
Current in the." Geophysical Research Letters 26(6): 2493-2496.
Stobart, B. 2000.A taxonomic reappraisal of Montipora digitata based on genetic and morphometric evidence. Zoological Studies 39:179-190.
Sunlu, U. 2003. Environmental impacts of tourism. In Conference on the Relationships between Global Trades and Local Resources in the Mediterranean Region.
Tanner, J.E., 1996. Seasonality and lunar periodicity in the reproduction of pocilloporid corals. Coral Reefs 15(1): 59-66.
Veron, J.E.N. 2000.Corals of the World. Townsville: Australian Institute of Marine Science. Vol 1-3. 1410 pp.
Villanueva, R.D., Yap, H.T. and Montano, M.N.E. 2008.Timing of planulation by pocilloporid corals in the northwestern Philippines. Marine Ecology Progress Series 370: 111-119.
Wyrtki, K. "Physical oceanography of the Indian Ocean". 1973.In The biology of the Indian Ocean. Springer Berlin Heidelberg. Pp. 18-36.
Yananto, A. and Sibarani, R.M., 2016. Analisis Kejadian El Nino Dan Pengaruhnya Terhadap Intensitas Curah Hujan di Wilayah Jabodetabek (Studi Kasus: Periode Puncak Musim Hujan Tahun 2015/2016). J. Sains & Teknologi Modifikasi Cuaca 17(2): 65-73.
24
Discussion and feedback